

高中化学鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型图文ppt课件
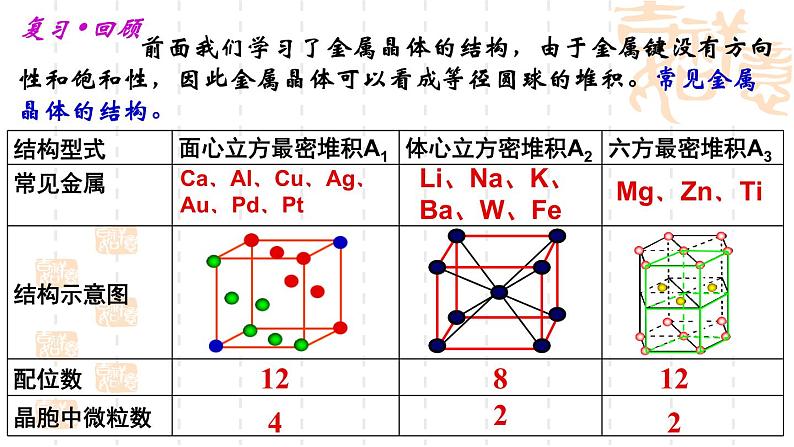
展开Li、Na、K、Ba、W、Fe
Ca、Al、Cu、Ag、Au、Pd、Pt
前面我们学习了金属晶体的结构,由于金属键没有方向性和饱和性,因此金属晶体可以看成等径圆球的堆积。常见金属晶体的结构。
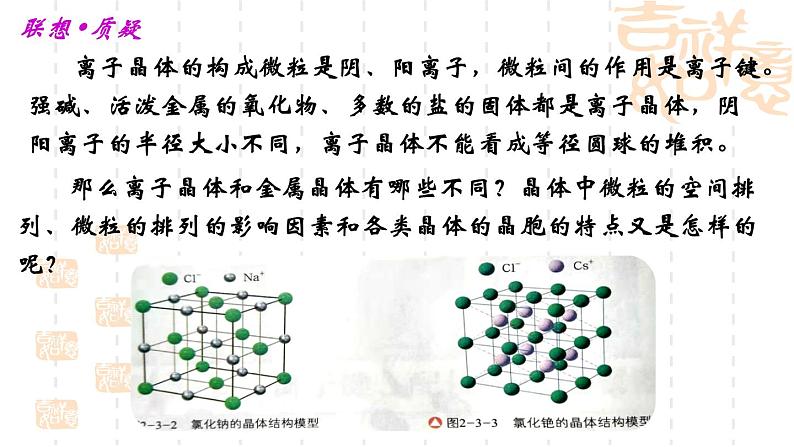
那么离子晶体和金属晶体有哪些不同?晶体中微粒的空间排列、微粒的排列的影响因素和各类晶体的晶胞的特点又是怎样的呢?
离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。强碱、活泼金属的氧化物、多数的盐的固体都是离子晶体,阴阳离子的半径大小不同,离子晶体不能看成等径圆球的堆积。
⑴定义:是阴、阳离子在空间呈现周期性重复排列所形成的晶体。
⑵构成离子晶体的微粒:阴、阳离子。
⑶离子晶体中微粒间的作用力:离子键(无饱和性、方向性)。
⑷常见的离子晶体:强碱、大多数盐、活泼金属氧化物。
⑸影响离子键强弱的因素: ①离子半径(阴阳离子的核间距)②离子所带电荷数
离子半径越小,离子所带电荷数越多,离子键越强、离子晶体的熔点越高。
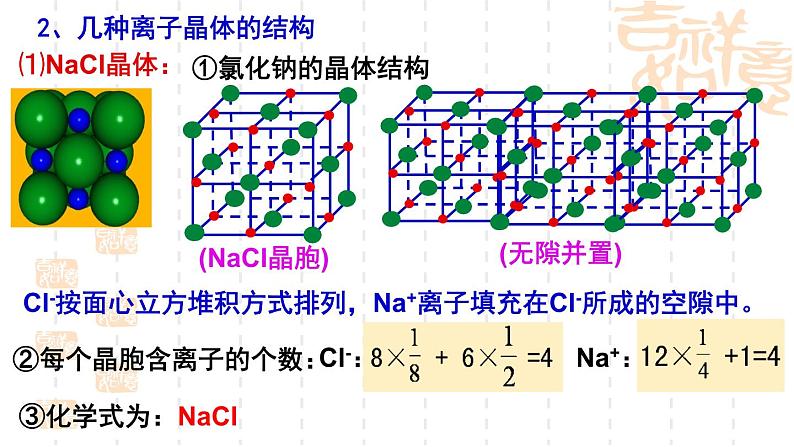
2、几种离子晶体的结构
Cl-按面心立方堆积方式排列,Na+离子填充在Cl-所成的空隙中。
②每个晶胞含离子的个数:
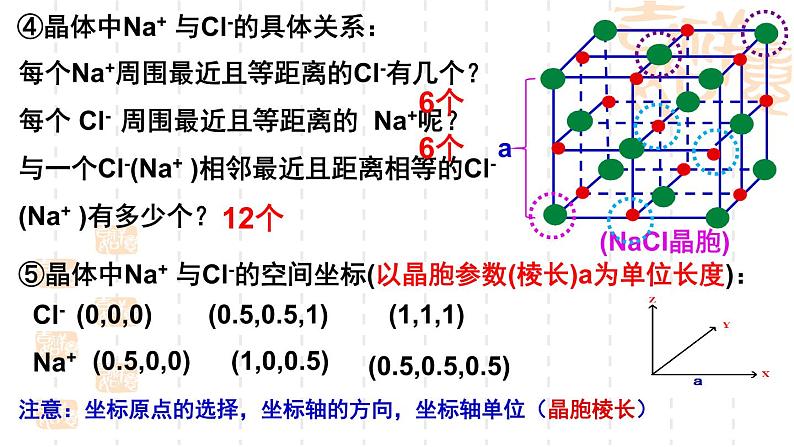
④晶体中Na+ 与Cl-的具体关系:
每个Na+周围最近且等距离的Cl-有几个?每个 Cl- 周围最近且等距离的 Na+呢?与一个Cl-(Na+ )相邻最近且距离相等的Cl-(Na+ )有多少个?
⑤晶体中Na+ 与Cl-的空间坐标(以晶胞参数(棱长)a为单位长度):
注意:坐标原点的选择,坐标轴的方向,坐标轴单位(晶胞棱长)
(0.5,0.5,1)
(0.5,0.5,0.5)
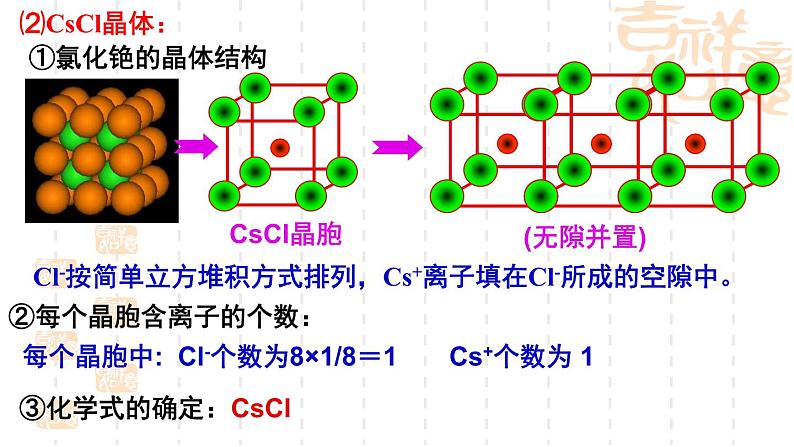
Cl-按简单立方堆积方式排列,Cs+离子填在Cl-所成的空隙中。
每个晶胞中: Cl-个数为8×1/8=1 Cs+个数为 1
③化学式的确定:CsCl
④晶体中Cs+ 与Cl-的具体关系:
每个Cs+周围最近且等距离的Cl-有几个?每个 Cl- 周围最近且等距离的Cs+呢?与一个 Cl-相邻最近且距离相等的 Cl-有多少个? 每个Cs+周围距离相等且最近的Cs+共有?
⑤晶体中Cs+与Cl-的空间坐标(以晶胞参数(棱长)a为单位长度)
(0.5,0.5,0.5)
S2-按 面心立方堆积方式排列,Zn2+ 离子填在S2-所成的空隙中。
③化学式的确定:ZnS
S2-个数为8×1/8+6×1/2=4 Zn2+个数为 4
④晶体中Zn2+ 与 S2- 的具体关系:
每个Zn2+周围最近且等距离的S2-有几个?每个 S2- 周围最近且等距离的Zn2+呢?与一个S2-(Zn2+)相邻最近且距离相等的S2-(Zn2+)有多少个?
⑤晶体中Zn2+ 与 S2- 的空间坐标(以晶胞参数(棱长)a为单位长度)
(0.5,0.5,0)
(0.25,0.25,0.75)
(0.75,0.75,0.75)
(0.75,0.25,0.25)
Ca2+按 面心立方堆积方式排列,F▬填在Ca2+所成的空隙中。
③化学式的确定:CaF2
Ca2+个数为8×1/8+6×1/2=4 F▬个数为 8
④晶体中Ca2+ 与 F▬ 的具体关系:
每个Ca2+ 周围最近且等距离的 F▬有几个?每个 F▬周围最近且等距离的Ca2+ 呢?与一个 Ca2+ )相邻最近且距离相等的Ca2+有多少个?与一个 F▬相邻最近且距离相等的 F▬有多少个?
⑤晶体中Ca2+ 与 F▬ 的空间坐标(以晶胞参数(棱长)a为单位长度)
(0.25,0.25,0.25)
(0.25,0.75,0.75)
(0.75,0.75,0.25)
(0.75,0.25,0.75)
4、晶格能的定义及影响因素
将1ml 离子晶体完全气化为气态阴、阳离子所吸收的能量。
一般而言,晶格能越大,离子晶体越稳定,晶体的熔点越高,硬度越大。在一定程度上可以用来衡量离子键的强弱。
⑶晶格能的影响因素:
规律:离子半径越小,离子所带电荷越多,晶格能越大;反之,越小。除此之外,晶格能的大小还与离子晶体的结构类型有关。
事实上,离子晶体远比我们想象的要复杂,构成晶体的离子未必都是单原子离子,如NH4+等阳离子,以及SO42-、CH3COO-、苯甲酸根离子( )等阴离子。在由这些离子构成的离子晶体中,随着离子体积的增大,阴、阳离子间的距离增大,离子之间的作用力减弱,晶体的熔点也随之降低。 在许多离子化合物的晶体中,微粒之间的相互作用不再是典型的离子键,而存在氢键、范德华力等作用力。这些晶体的熔点远比NaCl等晶体低得多,有些离子构成的物质在常温下甚至以液态形式存在。
(3)在固态时不导电,熔融状态或在水溶液中能导电。
5、离子晶体的物理性质
(1)熔点较高,而且随着离子电荷的增加,离子间距的缩短,晶格能增大,熔点升高。
(2)一般易溶于水,而难溶于非极性溶剂。
例1、NaCl晶体模型如下图所示:
(1)在NaCl晶体中,每个Cl-周围同时吸引着___个Na+;在NaCl晶胞中含有___个Na+、____个Cl-,晶体中每个Na+周围与它距离最近且相等的Na+共有______个。
(2)对于氯化钠晶体,下列描述正确的是( ) A.它是六方最密堆积 B.相邻的阴、阳离子核间距等于阴、阳离子半径之和 C.氯化钠晶体与氯化铯晶体结构相同 D.每个Na+与6个Cl-邻近
例2、同类晶体物质熔点的变化是有规律的,试分析下表所列两组物质熔点呈规律性变化的原因:
晶体熔点的高低,决定于构成晶体微粒间的作用力的大小。 A组是 晶体,晶体微粒之间通过 结合,离子半径由大到小的顺序是 ,离子键强度由小到大的顺序是 。 B组晶体属 晶体,价电子数由少到多的顺序是 ,金属键强度由小到大的顺序是 。
r(Cs+)>r(K+)>r(Na+)
CsCl
①NaBr晶体比NaCl晶体晶格能 (填“大”或“小”),主要原因是 。 ②MgO晶体比NaCl晶体晶格能大,主要原因是 。③NaBr、NaCl和MgO晶体中,熔点最高的是 。
NaBr的离子核间距比NaCl的大
氧化镁晶体中的阴、阳离子所带电荷更多,并且离子的核间距更小
(2)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因:
其原因是 。
两者均为离子化合物,且阴、阳离子所带电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低
O2-半径小于S2-半径,Cu2O的离子键强于Cu2S的离子键,所以Cu2O的熔点比Cu2S的高
类型相同,结构相似,比较离子键的强弱,比较半径大小
1、下列性质可以证明NaCl是离子化合物的是( ) A.可溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态下能导电
2、下列说法正确的是( ) A.晶体中若存在阴离子,就一定存在阳离子 B.离子晶体不一定是化合物 C.离子晶体都易溶于水 D.离子晶体一定是由活泼金属和活泼非金属形成的
3、下列性质适合于离子晶体的是( ) A、熔点1070℃,固态不导电,液态能导电 B、熔点10.31℃,液态不导电,水溶液能导电 C、能溶于CS2,熔点112.8 ℃,沸点444.6 ℃ D、熔点97.81℃,质软,导电,密度0.97g·cm-3
4、下列关系正确的是( ) A、熔点:NaI > NaBr B、硬度:MgO>CaO C、晶格能:NaCl
高中鲁科版 (2019)第2节 几种简单的晶体结构模型说课课件ppt: 这是一份高中鲁科版 (2019)第2节 几种简单的晶体结构模型说课课件ppt
高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教案配套课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教案配套课件ppt
2020-2021学年第2节 几种简单的晶体结构模型教课课件ppt: 这是一份2020-2021学年第2节 几种简单的晶体结构模型教课课件ppt













