



高中化学鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型集体备课ppt课件
展开铜、钠、镁等金属的晶体是由金属阳离子和自由电子之间通过金属键的作用形成的,由于金属键没有方向性和饱和性,因此金属晶体可以看成等径圆球的密堆积。
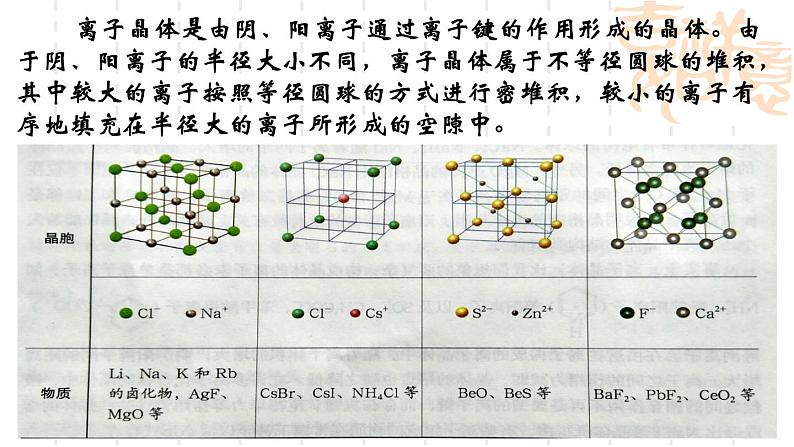
离子晶体是由阴、阳离子通过离子键的作用形成的晶体。由于阴、阳离子的半径大小不同,离子晶体属于不等径圆球的堆积,其中较大的离子按照等径圆球的方式进行密堆积,较小的离子有序地填充在半径大的离子所形成的空隙中。
共价晶体是由原子通过共价键结合形成的晶体,由于共价键键具有方向性和饱和性,晶体中,在一个原子周围的其它原子的数目是有限的,原子的堆积方向也是确定的,因此,共价晶体中的微粒堆积不服从紧密堆积原理。
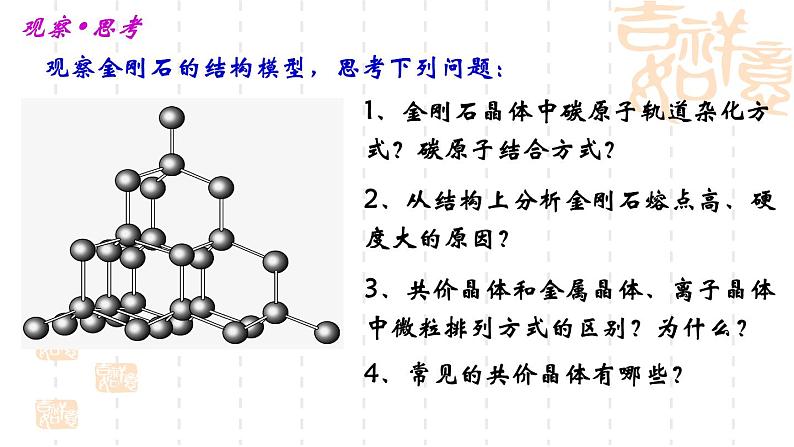
金刚石的晶体就是由碳原子通过共价键的作用形成的共价晶体,组成金刚石的碳原子通过共价键形成了正四面体的构型。
自然界中的金刚石的形成经历了地壳运动的高温、高压的特殊环境。金刚石具有熔点高、不导电、硬度大的优良性质,这些性质是由金刚石的结构决定的,那么金刚石具有怎样的结构呢?
1、金刚石晶体中碳原子轨道杂化方式?碳原子结合方式?
观察金刚石的结构模型,思考下列问题:
2、从结构上分析金刚石熔点高、硬度大的原因?
3、共价晶体和金属晶体、离子晶体中微粒排列方式的区别?为什么?
4、常见的共价晶体有哪些?
⑴定义:相邻原子间以共价键相结合而形成空间立体网状结构的晶体。
⑶微粒间的作用: 原子间以较强的共价键相结合。共价键具有方向性和饱和性。共价晶体中的微粒堆积不服从紧密堆积原理。
⑵构成微粒:构成共价晶体的微粒是原子。
某些氧化物:二氧化硅( SiO2)晶体等
某些单质:金刚石(C)、晶体硅(Si)、 晶体硼(B)、晶体锗(Ge)等
某些非金属化合物:碳化硅(SiC)晶体、氮化硼(BN)晶体等
2.几种典型的共价晶体
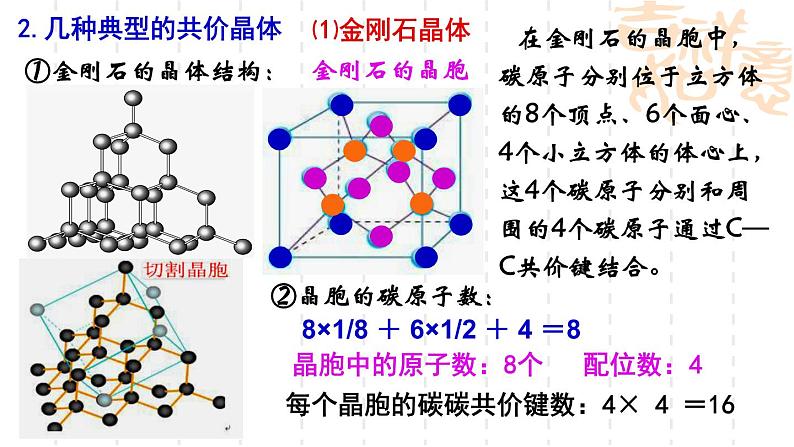
在金刚石的晶胞中,碳原子分别位于立方体的8个顶点、6个面心、4个小立方体的体心上,这4个碳原子分别和周围的4个碳原子通过C—C共价键结合。
8×1/8 + 6×1/2 + 4 =8
每个晶胞的碳碳共价键数:4× 4 =16
晶胞中的原子数:8个 配位数:4
在晶体中每个碳以共价键键与相邻4个碳结合,无限延伸形成空间立体网状结构。碳原子以sp3杂化轨道与周围4个碳原子以共价键相结合,C—C键间的夹角为109028'。每个最小的碳原子环上有6个碳原子。
③金刚石的晶体中的原子成键情况:
思考:在金刚石晶体中每个碳原子被几个六元环共用?
每个碳原子成4个碳碳键a、b、c、d,四个碳碳键中任选2个,有六种情况:ab、ac、ad、bc、bd、cd。
每两个碳碳键被两个六元环公用,所以四个碳碳键被12个六元环共用。所以个碳原子被12个六元环共用。
A、 B、 C、D、 E、
金刚石晶胞的参数(边长)为a,C半径为r 。
立方体体对角线长度就是C—C键的键长2r的4倍。
⑤晶体中C的空间坐标(以晶胞参数(棱长)a为单位长度)
(0.5,0.5,0)
(0,0.5,0.5)
(0.5,0,0.5)
(0.25,0.25,0.25)
(2)碳化硅(SiC)晶体
SiC晶胞中,硅原子位于立方体的8个顶点和6个面心位置,碳原子位于由大立方体分割成的8个小立方体中的4个的体心处。每个碳原子与周围的4个硅原子成键。
①碳化硅(SiC)的晶体结构:
Si原子数:8×1/8 + 6×1/2 =4
每个晶胞的碳硅共价键数:4× 4 =16
③碳化硅的化学式:SiC
在SiO2晶体的晶胞中每个硅原子与周围4个氧原子形成共价键形成硅氧四面体,每个氧原子与周围2个硅原子形成共价键;形成空间立体网状结构。
①SiO2的晶体结构:
②SiO2的晶胞中的原子数:
Si原子数:8×1/8 + 6×1/2 + 4 =8 O原子数:4×4 =16
③二氧化硅的化学式:SiO2
每个晶胞中Si-O共价键数数:16×2 =32
SiO2的晶体结构的多样性
(O-Si-O)109028'(Si-O-Si)?≠1800
C:4个 Si:4个
Si:8个 O:16个
(4)共价晶体一般具有熔点高、硬度大、不溶于溶剂,一般不导电等特点。
(1)共价晶体的构成微粒是原子,只存在共价键,不存在其他作用力。
(2)共价晶体的化学式表示其比例组成,在晶体中不存在分子。
(3)共价晶体为空间立体网状结构,可把整个原子晶体看成一个巨型分子。共价键具有方向性和饱和性,使共价晶体中某个原子周围结合的其他原子是有限的,因此比较松散。共价晶体中的微粒堆积不服从紧密堆积原理。但是由于整个晶体中各原子都以强作用力共价键相互结合,且构成了空间网状结构,所以共价晶体更稳定。
(1)键能由大到小的顺序: 。(2)熔点由高到低的顺序: 。(3)硬度由大到小的顺序: 。得到的规律是:对结构相似的共价晶体来说,原子半径 ,键长 ,键能 ,晶体的熔点就越高,硬度越大。
部分共价晶体的键能、熔点和硬度
C-C、C-Si、Si-Si
金刚石、碳化硅、晶体硅
4、共价晶体及共价晶体熔点高低和硬度大小的判断方法
⑵共价晶体中原子间以较强的共价键相结合,对于结构相似的共价晶体来说,原子半径越小,键长越短,键能越大,晶体的稳定性越强,熔点越高,硬度越大。 原子半径越大,键长越长,共价键越不稳定,对应物质的熔点越低、硬度越小。
⑴共价晶体的判断依据 根据共价晶体的构成微粒和微粒间作用力判断,或根据共价晶体的物理性质判断。共价晶体通常:①熔点很高;②硬度大;③一般不导电;④难溶于溶剂。
例1、根据下列物质的性质,判断其属于共价晶体的是( ) A.熔点2 700 ℃,导电性强,延展性强 B.无色晶体,熔点3 550 ℃,不导电,质硬,难溶于水和有机溶剂 C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电 D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电
例2、氮化铝(AlN)常用作砂轮及高温炉衬材料,熔融状态下不导电,可知它属于( ) A.离子晶体 B.共价晶体 C.分子晶体 D.无法判断
例3、关于金刚石的下列说法中,错误的是( ) A.晶体中不存在独立的分子 B.碳原子间以共价键相结合 C.是硬度最大的物质之一 D.化学性质稳定,即使在高温下也不会与氧气发生反应
例4、在金刚石的网状结构中,含有共价键形成的碳原子 环,其中最小的环上,碳原子数是( ) A. 2个 B. 3个 C. 4个 D. 6个
例5、如果把SiO2的晶体结构想象为在晶体硅的Si—Si键之间插入O原子。根据SiO2晶体结构图,下列说法不正确的是( )
A.石英晶体中每个Si原子通过Si—O极性键与4个O原子作用 B.每个O原子也通过Si—O极性键与2个Si原子作用 C.石英晶体中Si原子与O原子的原子个数比为1∶2,可用“SiO2”来表示石英的组成 D.在晶体中存在石英分子,故石英的分子式为SiO2
例6、二氧化硅是立体的网状结构,其晶体模型如图所示,请认真观察该晶体模型后回答以下问题:
(1)二氧化硅晶体中最小环为________元环。(2)每个硅原子为______个最小环共有;每个最小环中有___个硅原子,__个氧原子。(3)每个最小环平均拥有________个硅原子, ______个氧原子。(4)1 ml SiO2中含有________ml Si—O键。
例7、单质硼有无定形和晶体两种,参考下表数据:
(1)晶体硼的晶体类型属于________,理由是____________________________________________________________________________。
晶体硼的熔沸点和硬度均介于金刚石和晶体硅之间,而金刚石和晶体硅都是共价晶体
(2)已知晶体硼的结构单元是由硼原子组成的正二十面体,如图所示,其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元由____个硼原子构成,其中B—B键的键角为____,共含有________个B—B键。
例8、(2020年山东高考试题17题)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
一个晶胞中有 个Sn,找出距离Cd(0,0,0)最近的Sn (用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有 个。
例9、现有几组物质的熔点(℃)数据:
据此回答下列问题:(1)由表格可知,A组熔点普遍偏高,据此回答:①A组属于_____晶体,其熔化时克服的粒子间的作用力是______。②硅的熔点低于二氧化硅,是由于________________________。③硼晶体的硬度与硅晶体相对比:_______________________。
Si—Si键键能小于Si—O键键能
(2)B组晶体中存在的作用力是________,其共同的物理性质是________(填序号)。①有金属光泽②导电性③导热性④延展性(3)C组中HF熔点反常是由于__________________________。(4)D组晶体可能具有的性质是________(填序号)。①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
高中鲁科版 (2019)第2节 几种简单的晶体结构模型说课课件ppt: 这是一份高中鲁科版 (2019)第2节 几种简单的晶体结构模型说课课件ppt
高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教案配套课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教案配套课件ppt
2020-2021学年第2节 几种简单的晶体结构模型教课课件ppt: 这是一份2020-2021学年第2节 几种简单的晶体结构模型教课课件ppt













