





高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第3节 氧化还原反应课文内容ppt课件
展开1.通过对化合价升降及得失电子的认识,由表及里地学习氧化还原反应的有关概念,逐步培养宏观辨识与微观探析的能力。2.探究元素化合价升降是电子转移的外在表现,从微观角度认识表示氧化还原反应的两种常见方法——双线桥法和单线桥法,培养电子守恒观念,建立证据推理与模型认知的核心素养。
1.氧化反应和还原反应物质与氧气发生的反应属于氧化反应,含氧化合物里的氧被夺去的反应,叫作还原反应。2.联想回忆初中涉及的“铜元素”的几个反应:
(1)2Cu+O2 2CuO(2)H2+ CuO Cu+H2O(3)Fe+CuSO4==Cu+FeSO4三个反应中,反应后铜元素化合价升高的是(1);铜元素化合价降低的是(2)(3)。
3.记忆常见元素化合价常见元素化合价口诀:一价氢钾钠氯银,二价氧钙钡镁锌,三铝四硅五价磷,说变价也不难,二三铁、二四碳、二四六硫都齐全,铜汞二价最常见。
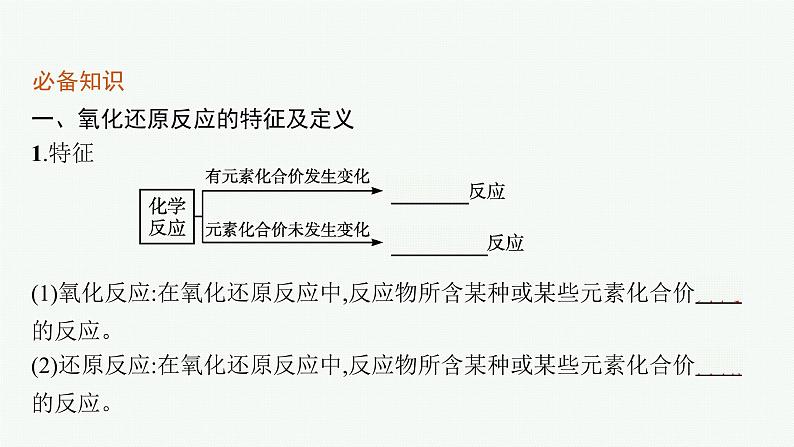
一、氧化还原反应的特征及定义1.特征
(1)氧化反应:在氧化还原反应中,反应物所含某种或某些元素化合价升高的反应。(2)还原反应:在氧化还原反应中,反应物所含某种或某些元素化合价降低的反应。
2.定义:在反应过程中有元素化合价变化的化学反应称为氧化还原反应。
【微思考1】凡是有单质参与的反应一定是氧化还原反应吗?提示 不一定。如O2与O3的转化不属于氧化还原反应。【微点拨】判断一个反应是不是氧化还原反应,关键是看反应前后元素化合价是否发生变化。
【微思考2】所有的化学反应都可以按照四种基本反应类型和氧化还原反应的标准划分吗?
提示 不可以。根据化合价是否发生变化,所有化学反应可分为氧化还原反应和非氧化还原反应;而四种基本反应类型不能包括所有的反应,如3CO+Fe2O3 3CO2+2Fe不属于四种基本反应类型。
二、氧化还原反应的实质1.以钠与氯气反应为例探究氧化还原反应的本质2Na+Cl2 2NaCl(1)钠原子失电子,化合价升高,发生氧化反应。(2)氯原子得电子,化合价降低,发生还原反应。
2.以金属铁与CuSO4溶液反应为例探究氧化还原反应的本质
(1)铁原子失电子,化合价升高,发生氧化反应。(2)铜离子得电子,化合价降低,发生还原反应。
3.结论(1)氧化还原反应的特征是元素化合价发生变化。(2)氧化还原反应的实质是发生了电子转移。
三、氧化还原反应中电子转移的表示方法1.双线桥法:表示同种元素的原子在反应前后电子得失或转移的情况。如:
2.单线桥法:表示反应过程中电子在反应物之间的转移情况,如:
【微思考3】下面的氧化还原反应中,电子转移方向和数目的表示正确吗?请说明理由。
提示 不正确。箭头连接方式不对,应该由氢元素指向铜元素。
判断下列说法是否正确,正确的画“√”,错误的画“×”。1.反应后有单质生成的化学反应一定是氧化还原反应。( )2.金属阳离子一定只具有氧化性。( )3.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。( )4.氧化还原反应中的反应物不是氧化剂就是还原剂。( )5.某元素从游离态变为化合态,该元素可能被氧化也可能被还原。( )6.1 ml Cl2与Ca(OH)2完全反应,转移的电子数是2NA。( )
(1)如何理解氧化反应和还原反应的关系?提示 氧化反应和还原反应同时存在于一个反应中,不能独立存在,所以人们把这样的一类化学反应叫作氧化还原反应。(2)复分解反应都不是氧化还原反应,你认为这个说法正确吗?说明你的理由。提示 正确。复分解反应是化合物相互交换成分,重新组合为新的化合物的反应,没有元素化合价的变化,一定不是氧化还原反应,属于非氧化还原反应。
(3)化合反应、分解反应不一定是氧化还原反应,你能举出相应的实例吗?
1.氧化还原反应的实质及特征
2.氧化还原反应与四种基本反应类型的关系
(1)置换反应一定是氧化还原反应。(2)复分解反应一定不是氧化还原反应。(3)有单质参加的化合反应是氧化还原反应。(4)有单质生成的分解反应是氧化还原反应。
例1(2020福建莆田第六中学高一月考)制备单质硅时,发生的主要化学反应如下:①SiO2+2C Si+2CO↑;②Si+2Cl2 SiCl4;③SiCl4+2H2 Si+4HCl。下列对上述三个反应的叙述不正确的是( )A.①③为置换反应B.①②③均为氧化还原反应C.三个反应的反应物中硅元素化合价均升高D.②为化合反应
解析 ①③反应为置换反应,A正确;①②③中均有单质参与反应,有化合价的变化,均为氧化还原反应,B正确;①③中Si元素的化合价由+4价降低到0价,②中硅元素化合价由0价升高到+4价,C错误;②为两种反应物生成一种化合物,为化合反应,D正确。
易错警示(1)凡是有元素化合价升降的化学反应都是氧化还原反应。氧化还原反应不一定有氧得失。在氧化还原反应中,并不一定是所有的元素化合价都发生改变,故不一定所有的元素都发生氧化还原反应。(2)氧化还原反应中,电子得失总数相等,化合价升降总数相等,且化合价的升降总数等于电子得失总数。
(3)凡有单质参加的化合反应、有单质生成的分解反应和置换反应都是氧化还原反应,没有单质参加的化合反应也有可能是氧化还原反应,如反应SO2+Na2O2==Na2SO4。有单质参加的反应不一定是氧化还原反应,如反应3O2 2O3。
(4)一种元素被氧化,不一定有另一种元素被还原,被氧化和被还原的元素可以是同一种元素。
变式训练1(双选)下列说法正确的是( )A.氧化还原反应的实质是电子的转移B.置换反应不一定是氧化还原反应C.氧化还原反应中并非所有元素的化合价都发生变化D.反应物中有单质的反应一定属于氧化还原反应
答案 AC解析 氧化还原反应的特征为有元素化合价发生变化,其实质是电子的转移,故A正确;置换反应是一种单质和一种化合物作用生成另外一种单质与另外一种化合物的反应,一定有元素的化合价变化,一定是氧化还原反应,故B错误;氧化还原反应中并非所有的元素化合价都发生变化,故C正确;反应2O3==3O2中,氧元素的化合价没有发生变化,属于非氧化还原反应,故D错误。
(1)氧化还原反应的实质是电子的转移,如钠与氯气的反应过程中钠原子失电子、氯原子得电子,如何表示氧化还原反应中电子的转移呢?
提示 不是。1 ml Fe2O3参加反应转移电子的物质的量是6 ml。
1.氧化还原反应中微粒间的转化关系
2.氧化还原反应中电子转移的表示方法(1)双线桥法。①基本步骤:
②注意事项:a.箭头、箭尾指向化合价变化的同种元素。b.“桥”上必须注明“得到”或“失去”字样、化合价变化情况及氧化或还原反应。c.失去电子总数与得到电子总数相等。
(2)单线桥法。①基本步骤:
②注意事项:a.单线桥必须画在反应物中。b.箭头指向得电子元素,箭尾是失电子元素。c.标明电子转移的总数,不标“得、失”。
例2(2020河南洛阳第一高级中学高一月考)已知KMnO4与浓盐酸反应的化学方程式为2KMnO4+16HCl(浓) ==2MnCl2+8H2O+2KCl+5Cl2↑。回答下列问题:(1)请用双线桥表示出该反应转移电子的方向和数目: 。 (2)被氧化的HCl占HCl总量的 ,被还原的元素是 (填元素符号)。 (3)当标准状况下有0.5 ml氯气生成时,该反应转移的电子数为 (设NA为阿伏加德罗常数的值)。 (4)15.8 g KMnO4与含1.2 ml HCl的浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成 g沉淀。
解析 (1)根据反应的化学方程式可知反应中Mn元素化合价从+7价降低到+2价,Cl元素化合价从-1价升高到0价,根据电子得失守恒可知,用双线桥表示出该反应转移电子的方向和数目为
(3)反应中氯元素化合价从-1价升高到0价,因此该反应中转移的电子的物质的量是0.5 ml×2=1 ml,即转移电子数为NA。(4)15.8 g KMnO4的物质的量是15.8 g÷158 g· ml-1=0.1 ml,完全反应消耗氯化氢0.8 ml。氯化氢的物质的量是1.2 ml,因此浓盐酸过量,生成氯气0.25 ml,根据氯原子守恒可知反应后溶液中氯离子的物质的量是1.2 ml-0.25 ml×2=0.7 ml,在反应后的溶液中加入足量的AgNO3溶液,可生成0.7 ml氯化银沉淀,其质量是0.7 ml×143.5 g· ml-1=100.45 g。
变式训练2已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O(1)用双线桥法表示电子转移的方向和数目: 。 (2)用单线桥法表示电子转移的方向和数目: 。 (3)若3 ml Cu参加反应,则该过程转移的电子是 ml。
解析 (1)该反应中铜元素的化合价变化是0价→+2价,1 ml Cu失去2 ml电子;HNO3中氮元素部分由+5价→+2价,生成1 ml NO,转移3 ml电子。(2)结合(1)的分析及单线桥法的注意事项即可写出。(3)1 ml Cu失去2 ml电子,故3 ml Cu失去6 ml电子。
易错警示(1)转移电子总数=得到的电子数=失去的电子数,即氧化还原反应中转移的电子总数与得到的电子数或失去的电子数相等,而不是二者的加和。如1 ml CuO参加反应生成Cu总共转移了2 ml电子,而不是4 ml电子。(2)单线桥和双线桥两种方法的形式不同,实质相同。在分析氧化还原反应中电子转移、化合价升降、元素被氧化(或被还原)等关系时,用“双线桥”方便,在表示电子转移的方向和数目时用“单线桥”方便。(3)双线桥法标电子转移时,电子转移数用be-×a形式表示,a表示发生氧化或还原反应的原子或离子的个数,b表示每个原子或离子得到或失去的电子数。
1.(2020天津耀华中学期中)下列反应中,氯元素全部被氧化的是( )A.2Fe+3Cl2==2FeCl3B.2NaCl 2Na+Cl2↑C.NaOH+HCl==NaCl+H2OD.2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
答案 B解析 Fe和Cl2反应时氯气中元素化合价降低被还原,故A错误;电解NaCl时氯元素化合价全部升高被氧化,故B正确;NaOH和HCl的反应不是氧化还原反应,故C错误;Cl2和Ca(OH)2的反应中氯气中的元素部分被氧化部分被还原,故D错误。
2.在空气中,有下列反应发生:①N2+O2 2NO;②2NO+O2==2NO2;③3NO2+H2O==2HNO3+NO;④2SO2+O2==2SO3;⑤SO3+H2O==H2SO4;⑥SO2+H2O==H2SO3;⑦3O2==2O3。其中属于氧化还原反应的是( )A.①②③④B.①②③④⑦C.①②④⑦D.①②③④⑤⑥⑦答案 A解析 判断一个反应是不是氧化还原反应,主要是看反应前后元素有没有化合价的变化,根据这个特征可以判断①②③④是氧化还原反应。
3.下列关于氧化还原反应的叙述,正确的是( )A.有一种元素发生氧化反应,肯定有另一种元素发生还原反应B.在反应中不一定所有元素的化合价都发生变化C.置换反应和复分解反应不可能是氧化还原反应D.化合反应和置换反应一定是氧化还原反应答案 B解析 A项,有可能是同种元素之间的氧化还原反应;C项,置换反应一定是氧化还原反应;D项,化合反应不一定是氧化还原反应。
4.(2020浙江嘉兴第一中学高一期中)下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A.Fe+CuSO4==FeSO4+CuB.3CO+Fe2O3 2Fe+3CO2C.AgNO3+NaCl==AgCl↓+NaNO3D.2KMnO4 K2MnO4+MnO2+O2↑
答案 B解析 反应Fe+CuSO4==FeSO4+Cu是置换反应,反应中有元素化合价的变化,属于氧化还原反应,A不符合题意;CO和Fe2O3在高温下的反应不属于任何一种基本反应类型,反应中有元素化合价的变化,属于氧化还原反应,B符合题意;AgNO3和NaCl的反应属于复分解反应,反应中元素化合价没有变化,不属于氧化还原反应,C不符合题意;D项反应属于分解反应,反应过程中元素化合价发生了变化,属于氧化还原反应,D不符合题意。
5.(2021湖南长沙高一期中)在反应2Fe2++4Br-+3Cl2==2Fe3++6Cl-+2Br2中,发生还原反应的粒子是( )A.Fe2+B.Br-C.Cl2D.Cl-答案 C解析 反应2Fe2++4Br-+3Cl2==2Fe3++6Cl-+2Br2中,铁元素的化合价由+2价升为+3价、溴元素化合价由-1价升为0价,化合价升高被氧化,发生氧化反应;氯元素化合价由0价降低为-1价,化合价降低被还原,发生还原反应,故发生还原反应的粒子为Cl2。
2020-2021学年第3节 氧化还原反应评课课件ppt: 这是一份2020-2021学年第3节 氧化还原反应评课课件ppt
化学必修 第一册第3节 氧化还原反应授课ppt课件: 这是一份化学必修 第一册第3节 氧化还原反应授课ppt课件
高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第3节 氧化还原反应习题ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第3节 氧化还原反应习题ppt课件,文件包含鲁科版高中化学必修第一册第2章元素与物质世界第3节氧化还原反应第1课时认识氧化还原反应课件ppt、鲁科版高中化学必修第一册第2章元素与物质世界第3节氧化还原反应第1课时认识氧化还原反应课后习题含答案doc等2份课件配套教学资源,其中PPT共43页, 欢迎下载使用。













