





所属成套资源:鲁科版化学必修第一册PPT课件全册
鲁科版 (2019)必修 第一册第3节 氮的循环教案配套课件ppt
展开
这是一份鲁科版 (2019)必修 第一册第3节 氮的循环教案配套课件ppt,共47页。PPT课件主要包含了内容索引,课前篇素养初探,课堂篇素养提升,知识铺垫,必备知识,化学性质,正误判断,问题探究,深化拓展,典例剖析等内容,欢迎下载使用。
1.通过对浓硝酸性质的学习,认识一氧化氮、二氧化氮、硝酸的物理性质和化学性质以及典型的实验现象,能书写主要反应的化学方程式,知道它们的主要应用,建立变化观念与平衡思想。2.通过了解人类活动对氮循环的影响,了解酸雨、光化学烟雾和水体富营养化等环境问题的危害以及如何减少氮氧化物的排放,树立环境保护的意识,同时知道常见氮的化合物在实验室中的安全使用注意事项,培养科学态度与社会责任。
3.从氮元素价态、物质类别角度构建氮及其化合物的转化关系,并能够应用其分析解释实验现象及物质的保存、检验、分离等问题;能够预测陌生的含有氮元素物质的性质、反应或实验现象,设计方案制备含有氮元素的物质和研究它们的性质,培养科学探究与创新意识。
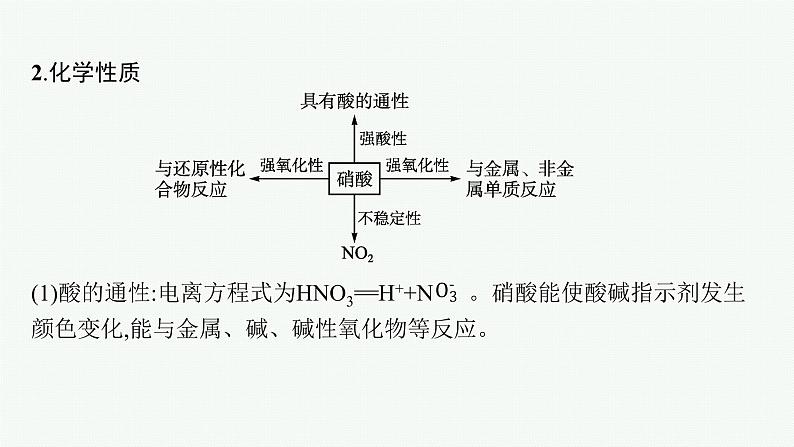
1.酸的通性(1)使酸碱指示剂变色(如使紫色石蕊变红)。(2)与活泼金属发生置换反应。(3)与碱性氧化物反应,生成盐和水。(4)与碱发生中和反应。(5)与盐发生复分解反应。2.在实验室和化工生产中常用的酸有盐酸、硫酸、硝酸(化学式为HNO3)、醋酸(CH3COOH)。
一、硝酸1.物理性质纯净的硝酸是无色、易挥发、有刺激性气味的液体,熔点为-42 ℃,沸点为83 ℃,密度为1.5 g·cm-3。通常市售硝酸中HNO3的质量分数为68%~70%,密度约为1.42 g·cm-3。HNO3的质量分数为95%以上的浓硝酸在空气中由于挥发出硝酸蒸气会产生发烟现象,通常叫作发烟硝酸。
(1)酸的通性:电离方程式为HNO3==H++N 。硝酸能使酸碱指示剂发生颜色变化,能与金属、碱、碱性氧化物等反应。
(2)不稳定性。浓硝酸受热或见光分解,化学方程式为4HNO3 4NO2↑+O2↑+2H2O。(3)强氧化性。
3.用途硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料和硝酸盐等。在实验室里,硝酸是一种重要的化学试剂。
【微思考1】为什么浓硝酸一般呈黄色?如何消除其黄色?提示 纯硝酸为无色液体,由于HNO3分解产生的NO2又溶于其中,故浓硝酸一般呈黄色;向浓硝酸中通入O2,可以消除其黄色。
二、人类活动对氮循环和环境的影响1.含氮物质的来源及其危害
2.减少人类活动对氮循环和环境影响的措施(1)控制进入大气、土壤和水体中含有氮元素的物质的量。(2)增强生态系统对含有氮元素的物质的吸收能力。
【微思考2】氮氧化物对环境的污染有哪些?提示 常见的污染类型(1)光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生一种有毒的烟雾。(2)酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。(3)破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。(4)NO与血红蛋白结合使人中毒。
判断下列说法是否正确,正确的画“√”,错误的画“×”。1.NO2溶于水生成硝酸,所以NO2是酸性氧化物。( )2.硝酸可与活泼金属反应生成盐和氢气。( )3.浓硝酸显黄色是因为含有NO2。( )4.硝酸与木炭的反应既表现出氧化性又表现出酸性。( )5.硝酸与金属反应时,主要是+5价的氮得电子。( )6.浓硝酸与浓盐酸按3∶1的体积比所得的混合物叫王水。( )7.硝酸电离出的H+能被Zn、Fe等金属还原成H2。( )8.常温下,向浓硝酸中投入铁片,会产生大量的红棕色气体。( )
硝酸与铜反应时,体现了硝酸的哪些性质?
提示 体现了硝酸的氧化性和酸性。硝酸被还原成氮的氧化物体现了氧化性,与金属结合成硝酸盐体现了硝酸的酸性。
浓硝酸和稀硝酸均具有强氧化性,主要是由于硝酸中的+5价的氮元素具有很强的得电子能力。其主要表现为能将大多数金属(除Au、Pt之外)溶解、能与很多非金属反应以及与某些还原性化合物发生反应。1.浓硝酸(1)与金属单质反应。浓硝酸与金属反应生成的气体主要是NO2。①与不活泼金属单质反应:2HNO3(浓)+Ag==AgNO3+NO2↑+H2O4HNO3(浓)+Cu==Cu(NO3)2+2NO2↑+2H2O②铁和铝常温下遇浓硝酸钝化,钝化是化学变化。
(2)与非金属单质反应。浓硝酸在加热条件下能与非金属单质反应,本身被还原为NO2,非金属单质一般被氧化成氧化物或酸。C+4HNO3(浓) CO2↑+4NO2↑+2H2OS+6HNO3(浓) H2SO4+6NO2↑+2H2O
2.稀硝酸稀硝酸常温下与绝大多数金属单质反应生成的气体主要是NO,不产生氢气。(1)稀硝酸与铜反应。8HNO3(稀)+3Cu==3Cu(NO3)2+2NO↑+4H2O
(2)稀硝酸与铁反应。
特别提醒:(1)硝酸与金属反应时,一般既表现强氧化性,又表现酸性,参加反应的硝酸部分被还原,还有一部分仍以N 形式存在。(2)浓硝酸与金属反应的过程中,浓度逐渐减小,还原产物有可能是NO和NO2的混合物,最终溶液中仍有N 。
例1足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 ml·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )A.60 mLB.45 mLC.30 mLD.15 mL
方法点拨守恒法突破硝酸与金属反应的计算题(1)思维模型。
(2)计算中守恒思想的应用。
变式训练1向25 mL 12.0 ml·L-1浓硝酸中加入足量的铜,充分反应后共收集到标准状况下2.24 LNO和NO2的混合气体(不考虑NO2与N2O4的相互转化),则参加反应的铜的质量为( )A.3.2 g B.6.4 gC.12.8 gD.19.2 g
答案 B解析 n(HNO3)=0.025 L×12.0 ml·L-1=0.3 ml,n(气体)=0.1 ml。因Cu足量,硝酸完全反应,由N原子守恒可知,0.3 ml=n[Cu(NO3)2]×2+0.1 ml,解得n[Cu(NO3)2]=0.1 ml,由Cu原子守恒可知n(Cu)=n[Cu(NO3)2]=0.1 ml,则参加反应的铜的质量为0.1 ml×64 g· ml-1=6.4 g,所以B项正确。
水体中的氮元素来源主要有哪些?有什么危害?提示 水体中的氮元素主要来源于工业废水、生活污水、农田灌溉以及水产养殖所投入的饵料和肥料等。水体中富含氮元素会导致水体富营养化,从而造成“赤潮”和“水华”。
要点笔记 1.pH
相关课件
这是一份必修 第一册第3节 氮的循环多媒体教学课件ppt,共58页。PPT课件主要包含了分点突破1,硝酸的性质,分点突破2,分点突破3等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)必修 第一册第3节 氮的循环教学演示ppt课件,共45页。PPT课件主要包含了学习目标,任务分项突破,课堂小结提升,学科素养测评,自主梳理,刺激性,易挥发,有刺激性气味,红棕色,NO2等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第一册第3节 氮的循环教学演示ppt课件,共60页。PPT课件主要包含了NO1,光化学烟雾,NO2,学习任务1学习任务2,NO3等内容,欢迎下载使用。









