




鲁科版 (2019)必修 第一册第1节 铁的多样性教课内容课件ppt
展开1.根据生产、生活中的应用实例或通过实验探究,培养宏观辨识与微观探析的化学核心素养。2.能通过实验探究和交流研讨,掌握Fe、FeO、Fe2O3、Fe(OH)2、Fe(OH)3的性质及典型实验现象,能书写主要的化学方程式和离子方程式。能主动进行交流,逐步提升科学探究与创新意识。3.通过从物质类别和元素价态两个角度研究物质性质的思路和方法去认识含铁物质在生产、生活中的应用,建立含铁物质的性质、实验现象、应用之间的联系,提升科学态度与社会责任。
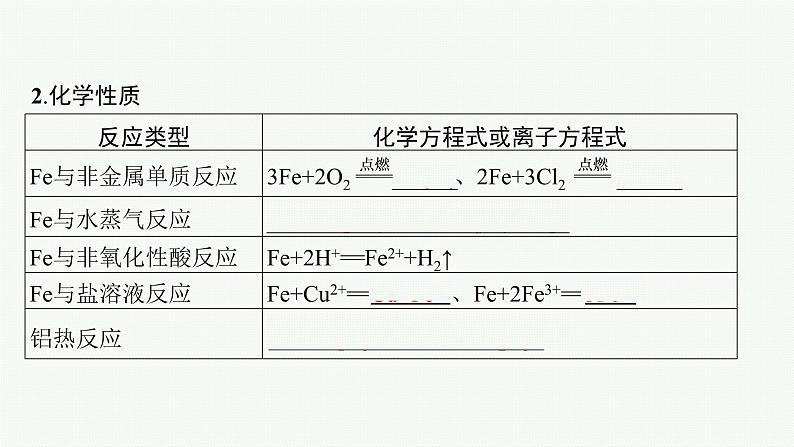
1.金属单质可以与非金属单质反应,可以与水或酸反应产生H2,可以与某些盐溶液发生置换反应,并且金属越活泼与水或酸反应越剧烈。2.碱性氧化物都是金属氧化物,可以与酸反应生成盐和水。如Na2O+2HCl==2NaCl+H2O,铁的氧化物也能与酸反应。
一、铁单质的性质1.物理性质铁单质为光亮的银白色金属,密度较大,熔点为1 538 ℃,纯铁有很强的抗腐蚀能力。有良好的延展性和导热性,导电性比铜、铝差,能被磁铁吸引。
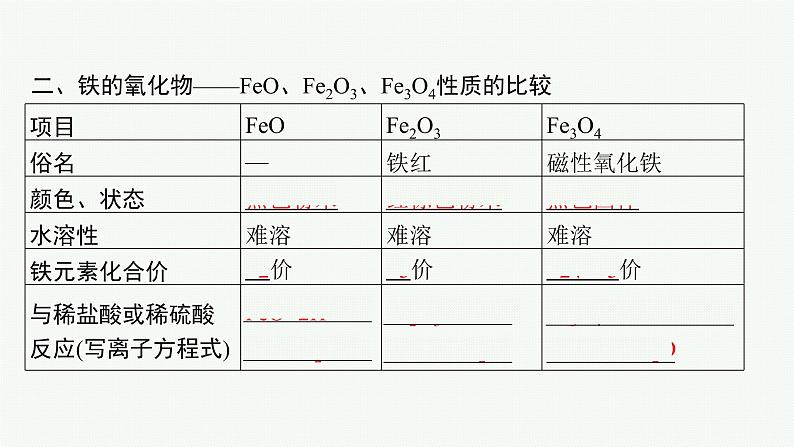
二、铁的氧化物——FeO、Fe2O3、Fe3O4性质的比较
三、铁的氢氧化物——Fe(OH)2、Fe(OH)3的性质比较
【微思考1】已知2Fe+3Cl2 2FeCl3和Fe+S FeS,请判断Cl2与硫单质氧化性的强弱?
提示 Cl2能将Fe氧化为+3价,硫单质只能将Fe氧化为+2价,说明Cl2的氧化性强于单质硫。
【微思考2】指出铁与水蒸气的反应、铝热反应中的氧化剂和还原剂。提示 铁与水蒸气的反应中铁做还原剂,水做氧化剂,说明铁具有还原性。铝热反应中铝做还原剂,氧化铁做氧化剂,说明氧化铁具有氧化性。
判断下列说法是否正确,正确的画“√”,错误的画“×”。1.Fe3O4是一种纯净物,而不是Fe2O3和FeO组成的混合物。( )2.赤铁矿的主要成分是Fe3O4,磁铁矿的主要成分是Fe2O3,FeO俗称铁红。( )3.Fe3O4、FeO遇非氧化性酸(如盐酸、稀硫酸)发生非氧化还原反应。( )4.Fe(OH)2在空气中加热得到FeO。( )5.Fe3O4只有氧化性,没有还原性。( )
6.Fe2O3不可与水反应得到Fe(OH)3,所以不能通过化合反应制取Fe(OH)3。( )7.铁的氧化物都不溶于水,也不与水反应。( )
在课堂分组实验中,小明同学不小心将少量铁粉混入铜粉中。小明同学欲将混合物遗弃,被小兵同学阻止,小兵运用所学知识成功将少量铁粉除去。除去铜粉中混有的铁粉,可选用FeCl3溶液吗?若不可以,可以选用什么试剂?另外还可以用什么方法?提示 由于FeCl3不仅与Fe反应,而且能与Cu反应,故不可以用FeCl3溶液除去铜粉中混有的铁粉;H2SO4和CuSO4溶液均与Fe反应而不与Cu反应,故可用H2SO4或CuSO4溶液除去铜粉中混有的铁粉。另外,铁能被磁铁吸引而铜不会,故也可用磁铁吸出铁粉。
(1)常温下,Fe与H2O不反应。但在水、空气中的O2等的共同作用下,Fe很容易被腐蚀。铁不能与热水反应,但在高温下,Fe能与H2O(g)反应:3Fe+4H2O(g) Fe3O4+4H2。(2)铁单质中铁元素的化合价为0价,铁单质具有还原性,能与具有氧化性的物质发生反应。
(3)Fe只具有还原性,可以被氧化剂氧化为Fe2+、Fe3+。①Fe能被I2、S、Fe3+、Cu2+、H+等氧化剂氧化为Fe2+,如Fe+S FeS,Fe+2Fe3+==3Fe2+。②Fe能被Cl2等强氧化剂氧化为Fe3+,如2Fe+3Cl2 2FeCl3。
例1(2020河北石家庄第二中学高一检测)铁是一种应用广泛的金属。下列有关铁的说法正确的是( )A.铁与盐酸反应生成氯化铁和氢气B.Fe与Cl2反应生成FeCl3C.铁在氧气中燃烧的生成物为三氧化二铁D.纯铁(块状)是黑色金属
答案 B解析 铁与盐酸反应生成氯化亚铁和氢气,A错误;铁与氯气反应生成三氯化铁,B正确;铁在氧气中燃烧的生成物为四氧化三铁,C错误;纯铁(块状)是银白色金属,D错误。
变式训练1下列物质与铁反应只生成+3价铁的化合物的是( )A.Cl2 B.盐酸 C.O2 D.CuSO4答案 A解析 Fe→Fe3+的转化需强氧化剂。铁在O2中燃烧生成的是Fe3O4,盐酸、CuSO4与Fe发生置换反应,生成的是+2价铁的化合物。
在学习铁及其化合物的性质时,同学们做了以下两个实验。已知苯是一种不溶于水的有机溶剂,密度比水的小。
(1)图甲实验中生成的产物是Fe3O4,可以写成FeO·Fe2O3的形式,那么Fe3O4是混合物吗?提示 不是。尽管Fe3O4中铁元素的化合价为+2价和+3价,可以写成FeO·Fe2O3的形式,但Fe3O4是一种化合物而非混合物。(2)图乙实验中制取的Fe(OH)2为什么能进行较长时间的观察?提示 苯浮在液面上层隔绝了空气,使生成的Fe(OH)2难以被氧化。
(1)Fe3O4是一种纯净物,而不是Fe2O3和FeO组成的混合物。能通过化合反应制得Fe(OH)3:Fe(OH)2、O2和H2O反应生成Fe(OH)3。(2)铁是典型的变价金属元素,常见价态有0价、+2价、+3价,其氧化物FeO、Fe2O3和Fe3O4都难溶于水,Fe(OH)2和Fe(OH)3都是难溶于水的弱碱。(3)Fe3O4、FeO遇非氧化性酸(如盐酸、稀硫酸)发生非氧化还原反应;遇强氧化性酸(如HNO3)发生氧化还原反应,+2价的铁均被氧化成+3价。
(4)Fe(OH)2在空气中加热不能得到FeO,因Fe(OH)2在空气中易被氧化,产物复杂。在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,反应的化学方程式为4Fe(OH)2+O2+2H2O==4Fe(OH)3。(5)由亚铁盐与铁盐制备Fe(OH)2和Fe(OH)3:FeCl2+2NaOH==Fe(OH)2↓+2NaCl,FeCl3+3NaOH==Fe(OH)3↓+3NaCl。
例2如图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色沉淀。关于此实验,下列说法正确的是( )A.装入药品后应关闭止水夹,等反应完成后再打开止水夹B.此装置是通过H2的排出使A中压强减小,从而将B中的烧碱溶液吸入A中产生Fe(OH)2C.H2的作用是排尽装置内的空气并将A中溶液压入B中D.在药品用量上硫酸应过量,使铁粉能充分反应完
答案 C解析 装入药品后应该打开止水夹,让铁与稀硫酸反应生成的氢气将装置中的空气排净,避免后来生成的氢氧化亚铁被氧化,故A项错误;该装置是利用铁与稀硫酸反应生成的氢气将A中生成的硫酸亚铁溶液压入B中,从而使硫酸亚铁与氢氧化钠溶液反应生成氢氧化亚铁,故B项错误;根据实验装置可知,本实验中氢气的作用有:先将装置中空气排净,然后关闭止水夹后将A中液体压入B中,故C项正确;亚铁离子易被氧化,为了避免硫酸亚铁被氧化,该实验中铁粉应该过量,故D项错误。
方法规律 实验室在制备Fe(OH)2时,因氢氧化亚铁在空气中极易与氧气、水反应生成氢氧化铁,因此实验中要隔绝空气。常采取以下措施:(1)亚铁盐需新制(用足量铁与稀硫酸反应或还原氯化铁溶液);(2)将所用氢氧化钠溶液煮沸以赶尽溶于其中的空气(O2);(3)使用长滴管吸入氢氧化钠溶液后将滴管伸入氯化亚铁溶液的液面以下,慢慢挤压乳胶头使氢氧化钠溶液与氯化亚铁溶液混合。
变式训练2下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是( )A.氢氧化亚铁易被空气氧化B.氢氧化亚铁为灰绿色沉淀C.可利用右图所示装置制备氢氧化亚铁D.实验中所用氢氧化钠溶液应预先煮沸
答案 B解析 氢氧化亚铁易被空气中的氧气氧化为氢氧化铁,故A项正确;氢氧化亚铁为白色沉淀,不是灰绿色,故B项错误;氢氧化亚铁的制备要隔绝空气,可将硫酸亚铁溶液滴入氢氧化钠溶液中,故C项正确;将硫酸亚铁滴入氢氧化钠溶液中可制取Fe(OH)2,氢氧化钠溶液预先煮沸可以将其中的空气排净,故D项正确。
1.下列变化中,加入铁粉不可能实现的是( )A.Ag+→AgB.Fe3+→Fe2+C.H+→H2D.Fe(OH)2→Fe(OH)3答案 D解析 Fe(OH)2→Fe(OH)3的过程中,Fe(OH)2被氧化,需加入氧化剂才能实现,铁粉不具有氧化性,D符合题意。
2.下列实验操作和现象、结论或目的均正确的是( )
解析 氧化铁和盐酸反应生成氯化铁和水,三价铁离子遇KSCN溶液会变红色,说明红砖中含有氧化铁,故A正确;CO还原Fe2O3得到单质Fe,即使有Fe3O4,其溶于盐酸后产生的少量Fe3+能与Fe发生反应Fe+2Fe3+==3Fe2+,加入KSCN溶液也不显红色,故B错误;N 和H+共存时具有强氧化性,而Fe2+具有还原性,会发生氧化还原反应,有Fe3+生成,遇KSCN溶液呈红色,不能证明样品是否变质,故C错误;若原溶液中不存在Fe2+而存在Fe3+,先通入Cl2再加入KSCN后溶液也会变红色,故D错误。
3.下列叙述正确的是( )①铁能被磁铁吸引 ②人体内的血红蛋白中含铁元素③Fe在纯氧中燃烧可得Fe2O3 ④Fe2O3能与水反应得Fe(OH)3,所以能通过化合反应制Fe(OH)3⑤Fe(OH)2在空气中加热,可得FeOA.①②B.②④C.②③④⑤ D.①②⑤
答案 A解析 ①铁能被磁铁吸引;②人体血红蛋白含铁元素;③铁在纯氧中燃烧可得Fe3O4;④Fe2O3不能与水反应,但Fe(OH)3可通过反应4Fe(OH)2+O2+2H2O==4Fe(OH)3制得;⑤Fe(OH)2在空气中加热,最终得到的是Fe2O3。
4.下列关于铁及其化合物的说法正确的是( )A.铁是地壳中含量最多的金属元素,因此在日常生活中应用最广B.FeCl2溶液存放时,在溶液中放入少量的铁粉,目的是防止Fe2+被氧化C.隔绝空气的情况下,向FeCl2溶液中加入Na2O2后得到Fe(OH)2D.FeO、Fe2O3、Fe3O4均为铁的氧化物,并且都是碱性氧化物
答案 B解析 铝是地壳中含量最多的金属元素,A项错误;Fe2+容易被空气中的氧气氧化为Fe3+,加Fe可防止Fe2+被氧化,B项正确;过氧化钠与水反应生成NaOH和O2,O2可将Fe2+氧化成Fe3+,因此向FeCl2溶液中加入Na2O2后得到红褐色的Fe(OH)3沉淀,C项错误;Fe3O4不是碱性氧化物,D项错误。
鲁科版 (2019)必修 第一册第1节 铁的多样性课文配套课件ppt: 这是一份鲁科版 (2019)必修 第一册第1节 铁的多样性课文配套课件ppt,共46页。PPT课件主要包含了学习目标,任务分项突破,课堂小结提升,学科素养测评,自主梳理,银白色,铁的氧化物,磁性氧化铁,铁的氢氧化物,白色沉淀迅速等内容,欢迎下载使用。
化学必修 第一册第1节 铁的多样性习题课件ppt: 这是一份化学必修 第一册第1节 铁的多样性习题课件ppt,文件包含鲁科版高中化学必修第一册第3章物质的性质与转化第1节铁的多样性第2课时铁铁的氧化物和铁的氢氧化物课件ppt、鲁科版高中化学必修第一册第3章物质的性质与转化第1节铁的多样性第2课时铁铁的氧化物和铁的氢氧化物课后习题含答案doc等2份课件配套教学资源,其中PPT共33页, 欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第1节 铁的多样性多媒体教学课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第1节 铁的多样性多媒体教学课件ppt,共27页。













