

2022届高考化学二轮专题复习学案练习专题二 考点二 一定物质的量浓度溶液的配制
展开配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验。复习时,要熟记实验仪器,掌握基本操作步骤,注意仪器的使用,正确分析误差,理解基本公式,明确高考题型,做到有的放矢。
1.七种仪器需记牢
托盘天平(或分析天平)、量筒、玻璃棒、容量瓶、胶头滴管、烧杯、药匙。
2.实验步骤要理清
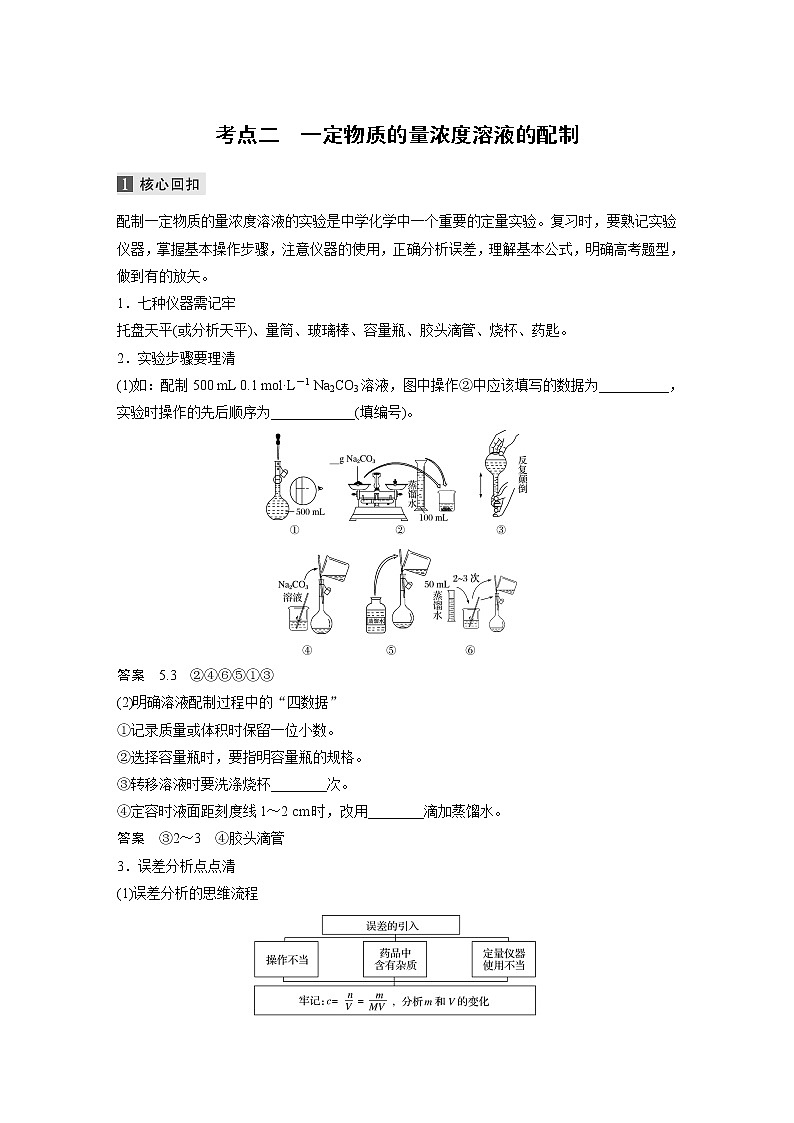
(1)如:配制500 mL 0.1 ml·L-1 Na2CO3溶液,图中操作②中应该填写的数据为__________,实验时操作的先后顺序为____________(填编号)。
答案 5.3 ②④⑥⑤①③
(2)明确溶液配制过程中的“四数据”
①记录质量或体积时保留一位小数。
②选择容量瓶时,要指明容量瓶的规格。
③转移溶液时要洗涤烧杯________次。
④定容时液面距刻度线1~2 cm时,改用________滴加蒸馏水。
答案 ③2~3 ④胶头滴管
3.误差分析点点清
(1)误差分析的思维流程
(2)视线引起误差的分析方法
①仰视容量瓶刻度线(图1),导致溶液体积偏大,结果偏低。
②俯视容量瓶刻度线(图2),导致溶液体积偏小,结果偏高。
(3)用“偏高”“偏低”或“无影响”填空:
①砝码生锈:偏高。
②定容时,溶液温度高:偏高。
③定容时俯视容量瓶刻度线:偏高。
④称量时物码颠倒且使用游码:偏低。
⑤未洗涤烧杯、玻璃棒:偏低。
⑥称量易吸水物质时间过长:偏低。
⑦转移时,有液体溅出:偏低。
⑧滴加蒸馏水超过容量瓶刻度线,再用胶头滴管吸出:偏低。
⑨定容摇匀后,液面低于刻度线,再加水至刻度线:偏低。
⑩容量瓶内有少量水:无影响。
4.溶液中溶质的质量分数与物质的量浓度之间的换算
c=eq \f(1 000ρw,M)(c为溶质的物质的量浓度/ml·L-1,ρ为溶液的密度/g·cm-3,w为溶质的质量分数,M为溶质的摩尔质量/g·ml-1)。
1.正误判断,正确的打“√”,错误的打“×”
(1)配制0.400 0 ml·L-1的NaOH溶液,称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容(×)(2018·全国卷Ⅱ,13A)
(2)配制浓度为0.010 ml·L-1的KMnO4溶液,可以称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度(×)(2017·全国卷Ⅲ,9D)
(3)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线(√)(2016·浙江理综,8D)
(4)称取2.0 g NaOH固体,可先在托盘上各放一张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体(×)(2015·福建理综,8A)
(5)配制一定浓度的NaCl溶液(×)(2015·四川理综,3A)
(6)洗净的锥形瓶和容量瓶可以放进烘箱中烘干(×)(2014·新课标全国卷Ⅰ,12A)
(7)用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体(×)
(2014·新课标全国卷Ⅰ,12D)
2.[2020·全国卷,27(1)]由FeSO4·7H2O固体配制0.10 ml·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、________________(从下列图中选择,写出名称)。
答案 烧杯、量筒、托盘天平
解析 根据用固体物质配制一定物质的量浓度溶液的配制方法可知,题图给出的仪器中还需要烧杯、量筒和托盘天平。
3.[2017·天津,9(1)]准确称取AgNO3基准物4.246 8 g(0.025 0 ml)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有______________________________________________________。
答案 250 mL(棕色)容量瓶、胶头滴管
解析 配制AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还需有250 mL(棕色)容量瓶、胶头滴管。
4.[2017·全国卷Ⅱ,28(3)]Na2SO3溶液常用作标准溶液滴定I2(2S2Oeq \\al(2-,3)+I2===2I-+S4Oeq \\al(2-,6)),但Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除________及二氧化碳。
答案 量筒 氧气
5.[2016·全国卷 Ⅱ,36(5)节选]一种双氧水的质量分数为27.5%(密度为1.10 g·cm-3),其浓度为________ml·L-1。
答案 8.9
解析 假设溶液的体积为1 L,则1 L溶液中含H2O2的质量:
m(H2O2)=1 000 mL×1.10 g·cm-3×27.5%=1.10×275 g
c(H2O2)=eq \f(n,V)=eq \f(\f(1.10×275 g,34 g·ml-1),1 L)≈8.9 ml·L-1。
题组一 有关一定物质的量浓度溶液的配制
1.将某市售食醋(浓度3.6 g/100 mL)稀释10倍,需要用到的仪器是( )
答案 A
解析 将某市售食醋(浓度3.6 g/100 mL)稀释10倍,属于浓溶液配制稀溶液,溶液配制需要用到的仪器为容量瓶。
2.下列实验操作或仪器选择正确的是( )
A.配制200 mL 0.1 ml·L-1CuSO4溶液需要称量硫酸铜固体3.2 g
B.配制1 ml·L-1 H2SO4溶液,量取浓硫酸后,将浓硫酸直接注入容量瓶中
C.配制1 ml·L-1 AlCl3溶液时,将氯化铝晶体溶于适量浓盐酸中,再加水稀释
D.称量4.0 g NaOH固体,溶解于1 L水中,即可配制0.1 ml·L-1的NaOH溶液
答案 C
解析 配制200 mL 0.1 ml·L-1CuSO4溶液需要选用250 mL容量瓶配制,需要硫酸铜固体的质量为0.25 L×0.1 ml·L-1×160 g·ml-1=4.0 g,故A错误;容量瓶不能用作稀释的容器,浓硫酸应该在烧杯中稀释并冷却后再转移到容量瓶中,故B错误;氯化铝能够水解,为了防止配制的溶液发生水解,应该将氯化铝晶体溶于适量浓盐酸中,再加水稀释到要求的浓度,故C正确;NaOH固体溶解于1 L水中得到的溶液体积不是1 L,故D错误。
3.用固体药品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
答案 B
解析 A项,用托盘天平称量药品时,应为“左物右码”,错误;B项,用玻璃棒搅拌能加速溶解,正确;C项,转移溶液时需要用玻璃棒引流,错误;D项,定容时,胶头滴管不能伸入容量瓶内,错误。
4.实验室用18.4 ml·L-1的浓硫酸配制480 mL 2 ml·L-1的硫酸,需量取浓硫酸______mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________________________。
答案 54.3 胶头滴管、500 mL容量瓶
解析 根据“大而近”的原则,配制480 mL溶液应选用500 mL容量瓶。根据c(浓溶液)×V(浓溶液)=c(稀溶液)×V(稀溶液),18.4 ml·L-1×V(浓H2SO4)=2 ml·L-1 ×500 mL,解得V(浓H2SO4)≈54.3 mL,需要量取浓硫酸54.3 mL。配制的实验步骤为:计算→量取→稀释→冷却→转移→洗涤→振荡→定容→摇匀→装瓶贴标签,配制时所用的玻璃仪器除量筒、烧杯和玻璃棒外,还需500 mL容量瓶、胶头滴管。
题组二 有关物质的量浓度的计算
5.相对分子质量为M的气态化合物V L(标准状况),溶于m g水中,得到质量分数为w的溶液,物质的量浓度为c ml·L-1,密度为ρ g·cm-3。则下列说法不正确的是( )
A.相对分子质量M=eq \f(22.4mw,1-wV)
B.物质的量浓度c=eq \f(1 000ρV,MV+22.4m)
C.溶液的质量分数w=eq \f(MV,22.4m)
D.溶液密度ρ=eq \f(cM,1 000w)
答案 C
解析 由c=eq \f(1 000ρw,M)知D项正确;由c=eq \f(\f(V,22.4),\f(\f(V,22.4)×M+m,ρ)×10-3)=eq \f(1 000ρV,MV+22.4m)知B项正确;由w=eq \f(\f(V,22.4)×M,m+\f(V,22.4)×M)=eq \f(MV,22.4m+MV)知C项错误,将此式变形后即可得到A项中的式子。
6.在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b ml BaCl2,恰好使溶液中的SOeq \\al(2-,4)完全沉淀,如加入足量强碱并加热可得到c ml NH3,则原溶液中Al3+的浓度(ml·L-1)为( )
A.eq \f(2b-c,2a) B.eq \f(2b-c,a)
C.eq \f(2b-c,3a) D.eq \f(2b-c,6a)
答案 C
解析 由混合溶液中加入b ml BaCl2,恰好使溶液中SOeq \\al(2-,4)完全沉淀,
则SOeq \\al(2-,4)+Ba2+===BaSO4↓
b ml b ml
c(SOeq \\al(2-,4))=eq \f(b ml,a L)=eq \f(b,a) ml·L-1,由加入足量强碱并加热可得到c ml NH3,
则NHeq \\al(+,4)+OH-eq \(====,\s\up7(△))NH3↑+H2O
c ml c ml
c(NHeq \\al(+,4))=eq \f(c ml,a L)=eq \f(c,a) ml·L-1,
又溶液呈电中性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+eq \f(c,a) ml·L-1×1=eq \f(b,a) ml·L-1×2,
解得x=eq \f(2b-c,3a) ml·L-1。
掌握两项技能
(1)用98%的浓H2SO4配制100 mL 1∶4的稀H2SO4:用量筒量取80 mL的水注入200 mL的烧杯中,然后再用另一只量筒量取20 mL的浓H2SO4沿着烧杯内壁缓慢注入水中,并用玻璃棒不停搅拌。
(2)配制100 g 20%的NaCl溶液:准确称量20.0 g NaCl固体,然后再转移到200 mL的烧杯中,再用量筒量取80 mL的水注入烧杯中,并用玻璃棒不停搅拌直到完全溶解为止。
最新高考化学考点一遍过(讲义) 考点06 一定物质的量浓度溶液的配制与计算: 这是一份最新高考化学考点一遍过(讲义) 考点06 一定物质的量浓度溶液的配制与计算,共17页。学案主要包含了一定物质的量浓度溶液的配制,物质的量浓度的计算方法等内容,欢迎下载使用。
2024届高考化学一轮复习专题1第3讲物质的量浓度及溶液的配制基础学案: 这是一份2024届高考化学一轮复习专题1第3讲物质的量浓度及溶液的配制基础学案,共34页。
高考化学 考点06 一定物质的量浓度溶液的配制与计算(含解析): 这是一份高考化学 考点06 一定物质的量浓度溶液的配制与计算(含解析),共13页。学案主要包含了一定物质的量浓度溶液的配制,物质的量浓度的计算方法等内容,欢迎下载使用。












