

2022届高考化学二轮专题复习学案练习专题四 考点二 元素及其化合物的转化关系
展开(一)钠及其化合物
钠是“极其活泼”金属的代表,学习钠的性质可类比知道第ⅠA族、第ⅡA族活泼金属的一般性质,复习时应从以下几个方面掌握:
1.树立物质转化思想
(1)理清知识主线
Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3
(2)形成网络构建
2.重要反应规范书写
用方程式回答下列问题。
(1)实验室怎样处理钠屑?
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑。
(2)写出Na与CuSO4溶液反应的离子方程式。
2Na+2H2O+Cu2+===Cu(OH)2↓+H2↑+2Na+。
(3)怎样将Na2CO3溶液转化为NaOH溶液(用化学方程式表示)。
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。
(4)向NaOH、Na2CO3、NaHCO3溶液中逐滴滴入盐酸,发生反应的离子方程式。
OH-+H+===H2O;COeq \\al(2-,3)+H+===HCOeq \\al(-,3);
HCOeq \\al(-,3)+H+===H2O+CO2↑。
(5)怎样除去CO2中的SO2气体(用离子方程式表示)。
SO2+2HCOeq \\al(-,3)===2CO2↑+SOeq \\al(2-,3)+H2O。
(6)怎样除去Na2CO3溶液中的NaHCO3(用离子方程式表示)。
HCOeq \\al(-,3)+OH-===COeq \\al(2-,3)+H2O。
(7)怎样除去NaHCO3溶液中的Na2CO3(用离子方程式表示)。
COeq \\al(2-,3)+H2O+CO2===2HCOeq \\al(-,3)。
(8)用化学方程式表示呼吸面具中产生O2的原理。
2Na2O2+2H2O===4NaOH+O2↑;
2Na2O2+2CO2===2Na2CO3+O2。
(二)铝及其化合物
铝是“氢前”且其氧化物、氢氧化物均具有两性的金属代表,它是典型的轻金属。学习铝的性质可类比知道铍、锌等元素的一般性质,复习时应从以下几个方面掌握:
1.树立物质转化思想
(1)理清知识主线
Al→Al2O3←Al(OH)3→eq \b\lc\{\rc\ (\a\vs4\al\c1(NaAlO2,AlCl3,Al2SO43,KAlSO42·12H2O))
(2)形成网络构建
2.重要反应规范书写
用方程式回答下列问题。
(1)用化学方程式表示除去铁粉中的铝粉。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
(2)用离子方程式表示除去Fe2O3中的Al2O3。
Al2O3+2OH-===2AlOeq \\al(-,2)+H2O。
(3)用离子方程式表示除去Mg(OH)2中的Al(OH)3。
Al(OH)3+OH-===AlOeq \\al(-,2)+2H2O。
(4)现有AlCl3溶液、氨水、NaOH溶液,制备Al(OH)3的最佳方案是(用化学方程式表示):
AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl。
(5)现有NaAlO2溶液、CO2、盐酸,制备Al(OH)3的最佳方案是(用离子方程式表示):
2AlOeq \\al(-,2)+CO2+3H2O===2Al(OH)3↓+COeq \\al(2-,3)
(或AlOeq \\al(-,2)+CO2+2H2O===Al(OH)3↓+HCOeq \\al(-,3))。
(6)用离子方程式表示泡沫灭火器的灭火原理。
Al3++3HCOeq \\al(-,3)===Al(OH)3↓+3CO2↑。
(7)用离子方程式分别表示
①Al3+、AlOeq \\al(-,2);②AlOeq \\al(-,2)、HCOeq \\al(-,3)不能大量共存的原理。
①Al3++3AlOeq \\al(-,2)+6H2O===4Al(OH)3↓;
②AlOeq \\al(-,2)+H2O+HCOeq \\al(-,3)===Al(OH)3↓+COeq \\al(2-,3)。
(8)铵明矾[NH4Al(SO4)2·12H2O]是常见的食品添加剂,用于焙烤食品,向铵明矾溶液中逐滴滴入NaOH溶液,试写出反应的离子方程式。
Al3++3OH-===Al(OH)3↓;
NHeq \\al(+,4)+OH-===NH3·H2O;
Al(OH)3+OH-===AlOeq \\al(-,2)+2H2O。
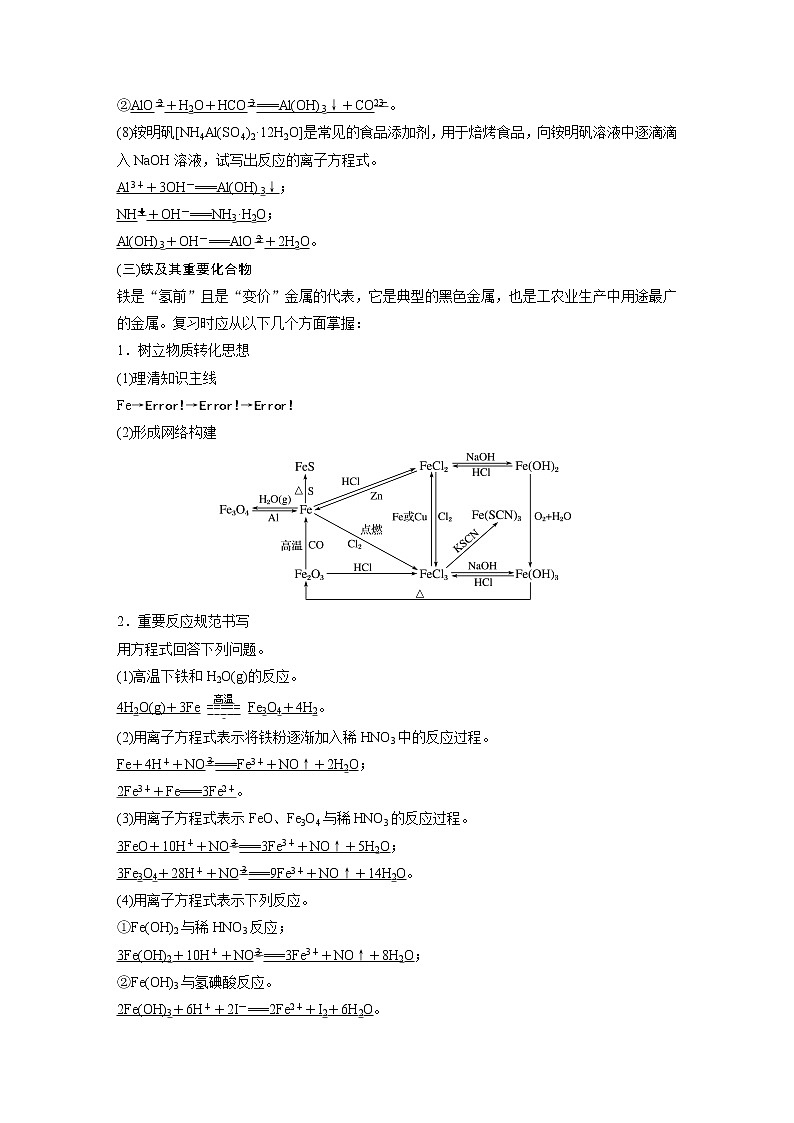
(三)铁及其重要化合物
铁是“氢前”且是“变价”金属的代表,它是典型的黑色金属,也是工农业生产中用途最广的金属。复习时应从以下几个方面掌握:
1.树立物质转化思想
(1)理清知识主线
Fe→eq \b\lc\{\rc\ (\a\vs4\al\c1(FeO,Fe2O3,Fe3O4))→eq \b\lc\{\rc\ (\a\vs4\al\c1(FeOH2,FeOH3))→eq \b\lc\{\rc\ (\a\vs4\al\c1(FeSO4·7H2O,FeCl3))
(2)形成网络构建
2.重要反应规范书写
用方程式回答下列问题。
(1)高温下铁和H2O(g)的反应。
4H2O(g)+3Feeq \(=====,\s\up7(高温))Fe3O4+4H2。
(2)用离子方程式表示将铁粉逐渐加入稀HNO3中的反应过程。
Fe+4H++NOeq \\al(-,3)===Fe3++NO↑+2H2O;
2Fe3++Fe===3Fe2+。
(3)用离子方程式表示FeO、Fe3O4与稀HNO3的反应过程。
3FeO+10H++NOeq \\al(-,3)===3Fe3++NO↑+5H2O;
3Fe3O4+28H++NOeq \\al(-,3)===9Fe3++NO↑+14H2O。
(4)用离子方程式表示下列反应。
①Fe(OH)2与稀HNO3反应;
3Fe(OH)2+10H++NOeq \\al(-,3)===3Fe3++NO↑+8H2O;
②Fe(OH)3与氢碘酸反应。
2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O。
(5)用方程式表示铁发生吸氧腐蚀生成铁锈的过程。
负极:2Fe-4e-===2Fe2+,
正极:O2+4e-+2H2O===4OH-,
Fe2++2OH-===Fe(OH)2↓,
4Fe(OH)2+O2+2H2O===4Fe(OH)3,
Fe(OH)3脱去一部分水生成Fe2O3·xH2O。
(6)怎样除去Fe2(SO4)3中的FeSO4(用适当的文字和离子方程式说明)。
答案 加入H2SO4酸化的H2O2,2H++2Fe2++H2O2===2Fe3++2H2O。
(7)怎样检验Fe2O3中的FeO(用适当的文字和离子方程式说明)。
答案 ①取少量样品于试管中,加稀H2SO4使其溶解,离子方程式为
Fe2O3+6H+===2Fe3++3H2O,
FeO+2H+===Fe2++H2O。
②再加入少量酸性KMnO4溶液,若紫红色褪去,证明溶液中含有Fe2+,原样品中含有FeO,离子方程式为
5Fe2++MnOeq \\al(-,4)+8H+===5Fe3++Mn2++4H2O。
(四)铜及其重要化合物
铜是“氢后”且是“变价”金属的代表,它是典型的有色金属,也是典型的重金属。复习时应从以下几个方面掌握:
1.树立物质转化思想
(1)理清知识主线
Cu→eq \b\lc\{\rc\ (\a\vs4\al\c1(Cu2O,CuO))←Cu(OH)2→eq \b\lc\{\rc\ (\a\vs4\al\c1(CuCl2,CuSO4,Cu2OH2CO3))
(2)形成网络构建
2.重要反应规范书写
用方程式回答下列问题。
(1)用两组化学方程式表示Cl2的氧化性大于S。
①2Fe+3Cl2eq \(=====,\s\up7(点燃))2FeCl3,Fe+Seq \(=====,\s\up7(△))FeS。
②Cu+Cl2eq \(=====,\s\up7(点燃))CuCl2,2Cu+Seq \(=====,\s\up7(△))Cu2S。
(2)铜在潮湿的空气中生锈。
2Cu+O2+H2O+CO2===Cu2(OH)2CO3。
(3)将Cu和浓H2SO4混合加热。
Cu+2H2SO4(浓)eq \(=====,\s\up7(△))CuSO4+SO2↑+2H2O。
(4)Cu和稀HNO3反应的离子方程式。
3Cu+8H++2NOeq \\al(-,3)===3Cu2++2NO↑+4H2O。
(5)常用FeCl3溶液腐蚀铜板(用离子方程式表示)。
Cu+2Fe3+===Cu2++2Fe2+。
(6)用惰性电极电解CuSO4溶液(用化学方程式表示)。
2CuSO4+2H2Oeq \(=====,\s\up7(电解))2Cu+O2↑+2H2SO4。
(五)碳、硅及其重要化合物
硅元素的非金属性不强,但其具有“亲氧”特性,使硅元素在自然界中没有游离态,只有化合态,其主要以二氧化硅和硅酸盐的形式存在。对于碳、硅两元素,复习时应从以下几个方面掌握:
1.树立物质转化思想
(1)理清知识主线
eq \(C,\s\up6(-4))H4←―eq \(C,\s\up6(0))―→eq \(C,\s\up6(+2))O―→eq \(C,\s\up6(+4))O2
eq \(Si,\s\up6(-4))H4←―eq \(Si,\s\up6(0))―→eq \(Si,\s\up6(+4))O2(H2eq \(Si,\s\up6(+4))O3)
(2)形成网络构建
2.重要反应规范书写
用方程式回答下列问题。
(1)Mg在CO2中燃烧。
2Mg+CO2eq \(=====,\s\up7(点燃))2MgO+C。
(2)“水滴石穿”的反应原理(用离子方程式表示)。
CaCO3+CO2+H2O===Ca2++2HCOeq \\al(-,3)。
(3)“钟乳石”的形成过程(用化学方程式表示)。
CaCO3+CO2+H2O===Ca(HCO3)2,
Ca(HCO3)2eq \(=====,\s\up7(△))CaCO3↓+CO2↑+H2O。
(4)向饱和Na2CO3溶液中通入过量CO2的离子方程式。
2Na++COeq \\al(2-,3)+CO2+H2O===2NaHCO3↓。
(5)氢氟酸不能用玻璃瓶盛放,其原因是(用化学方程式表示):
SiO2+4HF===SiF4↑+2H2O。
(6)盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是(用离子方程式表示):
SiO2+2OH-===SiOeq \\al(2-,3)+H2O。
(7)侯氏制碱法的原理(用化学方程式表示)。
CO2+NH3+NaCl+H2O===NaHCO3↓+NH4Cl。
(六)卤素及其重要化合物
“氯”是典型的活泼非金属元素,在自然界中以化合态形式存在,复习时应从以下几个方面掌握:
1.树立物质转化思想
(1)理清知识主线
Heq \(Cl,\s\up6(-1))―→eq \(Cl,\s\up6(0))2―→Heq \(Cl,\s\up6(+1))O―→Heq \(Cl,\s\up6(+3))O2―→Heq \(Cl,\s\up6(+5))O3―→Heq \(Cl,\s\up6(+7))O4
(2)形成网络构建
2.重要反应规范书写
用方程式回答下列问题。
(1)实验室用MnO2和浓盐酸反应制取Cl2的化学方程式。
MnO2+4HCl(浓)eq \(=====,\s\up7(△))MnCl2+Cl2↑+2H2O。
(2)将浓盐酸滴到KMnO4固体上(用离子方程式表示)。
2MnOeq \\al(-,4)+16H++10Cl-===2Mn2++5Cl2↑+8H2O。
(3)将Cl2通入石灰乳中(用化学方程式表示)。
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
(4)在空气中漂白粉漂白的原理(用化学方程式表示)。
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO。
(5)向FeBr2溶液中通入少量Cl2的离子方程式。
2Fe2++Cl2===2Fe3++2Cl-。
(6)向FeBr2溶液中通入等物质的量Cl2的离子方程式。
2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-。
(7)向FeBr2溶液中通入过量Cl2的离子方程式。
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
(8)将SO2和Cl2混合,漂白性减弱的原因(用离子方程式表示)。
SO2+Cl2+2H2O===4H++SOeq \\al(2-,4)+2Cl-。
(七)硫及其重要化合物
硫是与化工生产、生活和生态环境密切相关的元素,在自然界中既可以以化合态存在,又可以以游离态存在。复习时应从以下几个方面掌握:
1.树立物质转化思想
(1)理清知识主线
H2eq \(S,\s\up6(-2))―→eq \(S,\s\up6(0))―→eq \(S,\s\up6(+4))O2―→eq \(S,\s\up6(+6))O3(H2eq \(S,\s\up6(+6))O4)
(2)形成网络构建
2.重要反应规范书写
用方程式回答下列问题。
(1)热的烧碱溶液可以除硫,其原因是(用离子方程式表示):
3S+6OH-eq \(=====,\s\up7(△))2S2-+SOeq \\al(2-,3)+3H2O。
(2)将SO2气体通入FeCl3溶液中,溶液由棕黄色变为浅绿色,其原因是(用离子方程式表示):
SO2+2Fe3++2H2O===SOeq \\al(2-,4)+2Fe2++4H+。
(3)S2-和SOeq \\al(2-,3)可以大量共存,但加入H2SO4后,则不能大量共存,其原因是(用离子方程式表示):
2S2-+SOeq \\al(2-,3)+6H+===3S↓+3H2O。
(4)将SO2通入BaCl2溶液中无明显现象,若加入KNO3则有白色沉淀生成,其原因是(用离子方程式表示):
3SO2+3Ba2++2NOeq \\al(-,3)+2H2O===3BaSO4↓+2NO↑+4H+。
(5)书写下列反应的化学方程式。
①将H2S气体通入CuSO4溶液中。
H2S+CuSO4===CuS↓+H2SO4。
②将SO2通入H2S溶液中。
2H2S+SO2===3S↓+2H2O。
③Cu和浓H2SO4混合加热。
Cu+2H2SO4(浓)eq \(=====,\s\up7(△))CuSO4+SO2↑+2H2O。
④C和浓H2SO4混合加热。
C+2H2SO4(浓)eq \(=====,\s\up7(△))CO2↑+2SO2↑+2H2O。
⑤实验室利用Na2SO3和浓H2SO4制SO2。
Na2SO3+H2SO4(浓)===Na2SO4+H2O+SO2↑。
(八)氮及其重要化合物
“氮”是与化工生产、生活和生态环境密切相关的另一重要元素,在自然界中既可以以游离态存在,又可以以化合态存在。复习时应从以下几个方面掌握:
1.树立物质转化思想
(1)理清知识主线
eq \(N,\s\up6(-3))H3―→eq \(N2,\s\up6(0))―→eq \(N,\s\up6(+1))2O―→eq \(N,\s\up6(+2))O―→eq \(N,\s\up6(+4))O2―→Heq \(N,\s\up6(+5))O3
(2)形成网络构建
2.重要反应规范书写
用方程式回答下列问题。
(1)书写离子方程式。
①将NH3通入AlCl3溶液中。
3NH3+3H2O+Al3+===Al(OH)3↓+3NHeq \\al(+,4)。
②将NO2通入NaOH溶液中。
2NO2+2OH-===NOeq \\al(-,3)+NOeq \\al(-,2)+H2O。
③将炽热的炭放入浓HNO3中。
C+4H++4NOeq \\al(-,3)eq \(=====,\s\up7(△))CO2↑+4NO2↑+2H2O。
(2)书写化学方程式。
①实验室用Ca(OH)2和NH4Cl制氨气。
Ca(OH)2+2NH4Cleq \(=====,\s\up7(△))CaCl2+2NH3↑+2H2O。
②将NH3通入灼热的CuO中,固体由黑色变红色。
2NH3+3CuOeq \(=====,\s\up7(△))N2+3Cu+3H2O。
③用NH3可以检验Cl2管道是否漏气,若漏气则有白烟生成。
8NH3+3Cl2===N2+6NH4Cl。
④制硝基苯。
+HO—NO2eq \(―――→,\s\up7(浓H2SO4),\s\d5(△))+H2O。
角度一 “化工流程”的微设计
1.(2018·全国卷Ⅰ,7)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是( )
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有Al、Fe、Li
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用硫酸钠代替碳酸钠
答案 D
解析 Li2SO4易溶于水,用硫酸钠代替碳酸钠,不能形成含Li沉淀,D项错误;合理处理废旧电池有利于保护环境和资源再利用,A项正确;LiFePO4中含有Li和Fe元素,正极片碱溶所得滤液中含有Al元素,B项正确;Fe2+能被HNO3氧化为Fe3+,Fe3+遇到碱液后沉淀,而另一种金属离子——锂离子遇到碳酸钠后沉淀,C项正确。
2.[2020·新高考全国卷Ⅰ(山东),9]以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SiO2,Fe(OH)3和Al(OH)3。下列说法错误的是( )
A.浸出镁的反应为MgO+2NH4Cl===MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
答案 B
解析 氯化铵溶液显酸性,与MgO反应,相当于MgO促进了氯化铵的水解,生成氨气,A项正确;一水合氨受热易分解,故沉镁时温度不可太高,B项错误;由流程图可知氨气可循环使用,沉镁过程中产生氯化铵,故氯化铵也可循环使用,C项正确;浸出过程中产生Fe(OH)3和Al(OH)3,沉镁过程中加氨水调节pH产生Mg(OH)2,利用三种离子氢氧化物Ksp的不同,使其先后沉淀而分离,D项正确。
角度二 “实验探究”微设计
3.(2017·全国卷Ⅰ,10)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )
A.①②③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
答案 B
解析 A项,气体从溶液中逸出易带出水蒸气,所以浓硫酸应放在③中,错误;B项,先通H2以排除空气,加热前应先检验H2的纯度,正确;C项,若先停止通H2,空气中的氧气有可能重新将W氧化,应先停止加热,再关闭活塞K,错误;D项,MnO2和浓盐酸反应制氯气需要加热,不能用启普发生器制备,错误。
1.(2020·河南省六市第二次联合调研)CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)[CuCl3]2-(aq)(无色溶液)。下列叙述正确的是( )
A.“浸取”过程中的主要反应为CuFeS2+4CuCl2===4CuCl+FeCl2+2S
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl-(aq)[CuCl3]2-(aq)平衡逆向移动,析出CuCl,Cl-浓度增大
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
答案 D
解析 由图中反应物、生成物结合原子守恒可知浸取中的主要反应为CuFeS2+3CuCl2===4CuCl+FeCl2+2S,故A错误;浸取所得到的FeCl2溶液,与Cu不反应,不能用来腐蚀覆在绝缘板上的铜箔,故B错误;加水向离子浓度增大的方向移动,加水有利于CuCl(s) +2Cl-(aq)[CuCl3]2-(aq)平衡逆向移动,析出CuCl,Cl-浓度减小,故C错误;CuCl难溶于乙醇,在空气中易被氧化,则为提高产率和纯度,可采用乙醇洗涤、真空干燥,故D正确。
2.(2020·黑龙江省大庆高三开学考)我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示,下列有关说法不正确的是( )
A.滤渣1的成分是SiO2 ,滤渣2的成分是Fe(OH)3
B.焙烧过程中主要反应的化学方程式为:2ZnS+3O2eq \(=====,\s\up7(焙烧))2ZnO+2SO2
C.溶液中的Cd2+可用锌粉除去,反应的离子方程式为:Zn+Cd2+===Zn2++Cd
D.若不通入氧气,其后果是无法除去杂质Fe2+
答案 A
解析 加入稀硫酸酸浸,FeS(未焙烧)、ZnO、Fe2O3、PbO、CdO和稀硫酸反应生成Fe2+、Zn2+、Fe3+、PbSO4、Cd2+,所以滤渣1为未反应的SiO2和生成的PbSO4;氧化除杂时,通入氧气,使Fe2+转化为Fe3+,加入ZnO调节溶液的pH,将Fe3+转化为Fe(OH)3而除去Fe3+,滤渣2为生成的Fe(OH)3,A错误;闪锌矿主要含有ZnS,还含有SiO2和少量FeS、CdS、PbS杂质,焙烧过程中发生的主要反应有2ZnS+3O2eq \(=====,\s\up7(焙烧))2ZnO+2SO2,B正确;Zn的金属性强于Cd,可以从溶液中将Cd置换出来,其离子反应方程式为:Zn+Cd2+===Zn2++Cd,C正确;氧化除杂时,通入氧气,使Fe2+转化为Fe3+,加入ZnO调节溶液的pH,将Fe3+转化为Fe(OH)3而除去Fe3+,若不通入氧气,无法除去杂质Fe2+,D正确。
3.(2020·东北三省三校高三联考)某化学学习小组利用如图装置来制备无水AlCl3(已知:无水AlCl3遇水能迅速发生反应)。下列说法正确的是( )
A.装置①中的试剂可能是二氧化锰
B.装置②、③中的试剂分别为浓硫酸、饱和食盐水
C.点燃④处酒精灯之前需排尽装置中的空气
D.球形干燥管中碱石灰的作用只有处理尾气
答案 C
解析 ①装置为氯气的制备装置,浓盐酸与MnO2需要在加热的条件下才能反应生成Cl2,缺少加热仪器,A选项错误;装置②的目的是除去氯气中的氯化氢,用饱和食盐水,装置③的目的是干燥氯气,用浓硫酸,B选项错误;因为Al能与空气中的氧气在加热的条件下发生反应,故点燃④处酒精灯之前需排尽装置中的空气,C选项正确;球形干燥管中的碱石灰的作用是防止空气中的水蒸气进入装置⑤中,并吸收过量的氯气防止污染环境,D选项错误。
4.(2020·福建省高三质量检测)某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。
下列说法正确的是( )
A.②中白色沉淀是BaSO3
B.①中可能有部分硫酸挥发了
C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
答案 B
解析 实验探究铜与浓硫酸的反应,试管①为发生装置,溶液仍为无色,原因可能是混合体系中水太少,无法电离出铜离子,有白雾说明有气体液化的过程,同时产生白色固体,该固体可能是无水硫酸铜;试管②、③中有白色沉淀生成,该沉淀应为硫酸钡,说明反应过程有SO3生成或者硫酸挥发,③中沉淀较少,说明三氧化硫或挥发出的硫酸消耗完全;试管④中品红褪色说明反应中生成二氧化硫,浸有碱的棉花可以处理尾气,据此分析作答。根据分析可知①中可能有部分硫酸挥发了,故B正确;冷却后的试管中仍有浓硫酸剩余,浓硫酸稀释放热,不能将水注入试管,会暴沸发生危险,故C错误;反应过程中SO3可能是氧气将二氧化硫氧化生成,若先往装置内通入足量N2,体系内没有氧气,则无SO3生成,试管②、③中将无沉淀产生,实验现象发生变化,故D错误。试管
①
②
③
④
实验现象
溶液仍为无色,有白雾、白色固体产生
有大量白色沉淀产生
有少量白色沉淀产生
品红溶液褪色
2023届高考化学二轮复习专题四常见元素及其重要化合物学案: 这是一份2023届高考化学二轮复习专题四常见元素及其重要化合物学案,共52页。
高考化学二轮复习专题4常见元素及其重要化合物学案: 这是一份高考化学二轮复习专题4常见元素及其重要化合物学案,共24页。
2022届高考化学二轮专题复习学案练习专题四 考点一 元素及其化合物的性质应用: 这是一份2022届高考化学二轮专题复习学案练习专题四 考点一 元素及其化合物的性质应用,共7页。












