



高中化学人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质备课ppt课件
展开冰山融化现象是物理变化还是化学变化?
冰山融化过程中有没有破坏其中的化学键?
那为什么冰山融化过程仍要吸收能量呢?
这说明水分子之间存在着相互作用力。
1. 概念:把分子聚集在一起的作用力,叫分子间作用力,也叫范德华力。 常见的有范德华力和氢键两类
2. 本质:属于分子间作用力的一种,本质是一种分子之间的静电作用。
3. 存在:广泛存在于各种分子之间。
二、构成物质的微粒之间的作用力
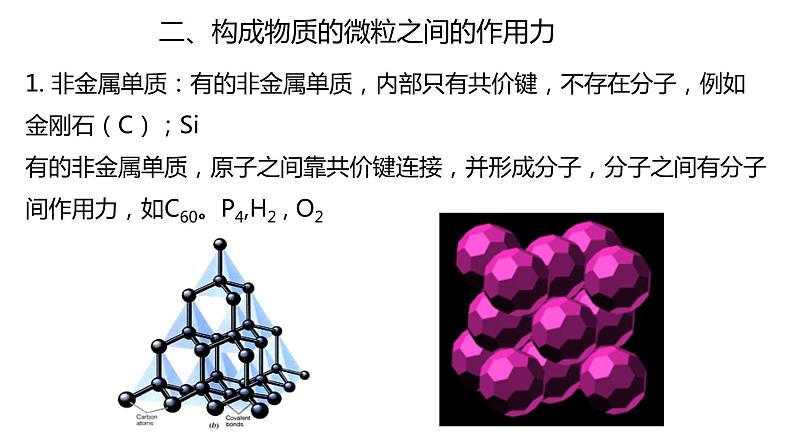
1. 非金属单质:有的非金属单质,内部只有共价键,不存在分子,例如金刚石(C);Si有的非金属单质,原子之间靠共价键连接,并形成分子,分子之间有分子间作用力,如C60。P4,H2 , O2
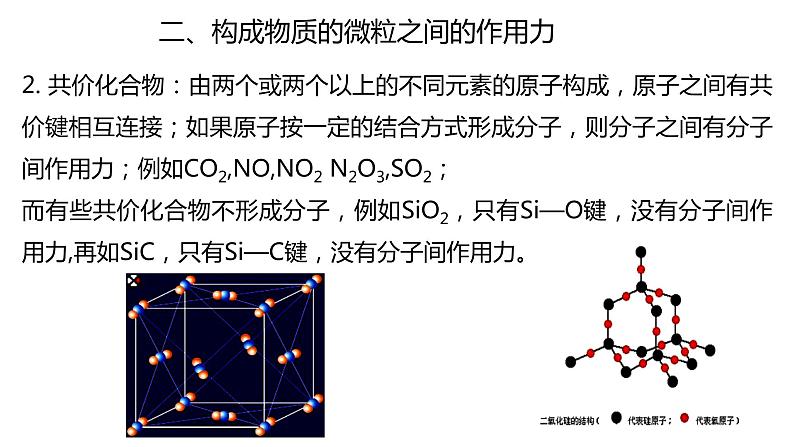
2. 共价化合物:由两个或两个以上的不同元素的原子构成,原子之间有共价键相互连接;如果原子按一定的结合方式形成分子,则分子之间有分子间作用力;例如CO2,NO,NO2 N2O3,SO2;而有些共价化合物不形成分子,例如SiO2,只有Si—O键,没有分子间作用力,再如SiC,只有Si—C键,没有分子间作用力。
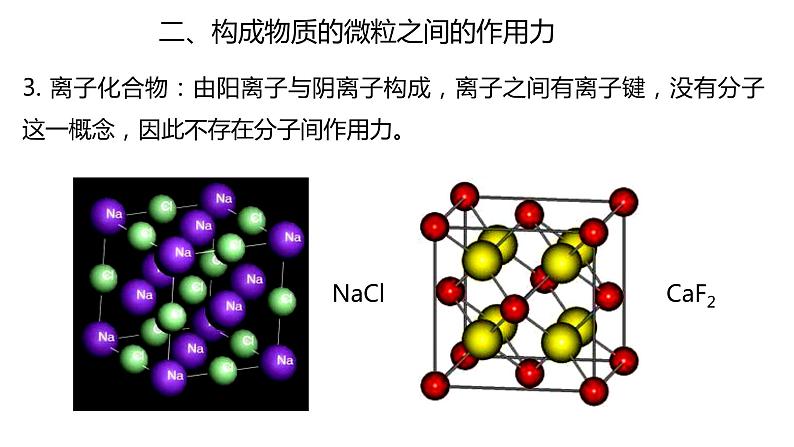
3. 离子化合物:由阳离子与阴离子构成,离子之间有离子键,没有分子这一概念,因此不存在分子间作用力。
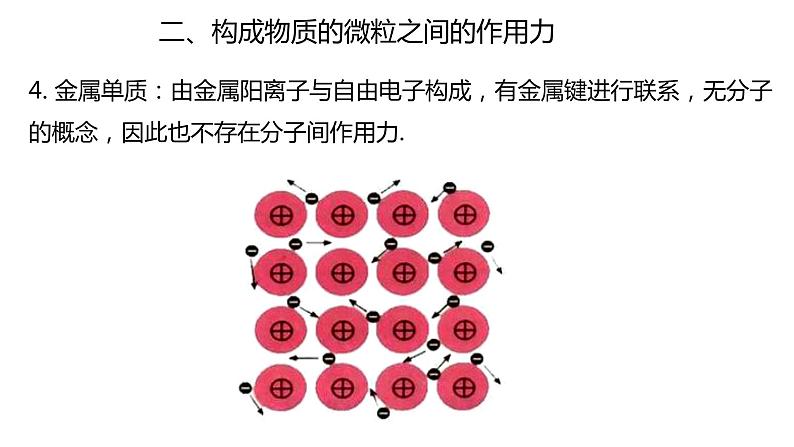
4. 金属单质:由金属阳离子与自由电子构成,有金属键进行联系,无分子的概念,因此也不存在分子间作用力.
是一种普遍存在于固体、液体和气体中分子间的作用力。
存在:非金属单质(除C、Si)分子、稀有气体分子、共价化合物(除SiO2)分子之间;石墨片层之间。
范德华力与共价键的区别(1)范德华力很弱,比化学键的键能小1∽2个数量级。(2)范德华力一般没有方向性和饱和性
哪些物质的微粒存在分子间作用力呢?
大多数共价化合物,例如:1. CO2、H2SO4、HF, H2O, AlCl3、各种有机化合物等等;2. 大多数非金属单质,例如: H2、P4、S8、C60、3. 各种稀有气体(例如Ar、Kr),等等
离子化合物,例如:NH4Cl、Al2O3、KF,等等;金属单质,例如:Cu、Fe、Na,等等;某些共价化合物,如石英SiO2,金刚砂 SiC某些非金属单质,如金刚石 C、晶体硅 Si,等等
分子的大小,分子的构型,分子的电荷分布等。
对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增大。相对分子质量相同或相近时,分子的极性越大,范德华力越大。
四、范德华力对物质性质的影响
①主要影响物质的熔沸点范德华力越强,物质的熔沸点越高。F2,Cl2, Br2, I2②可以影响物质的溶解度例如;稀有气体在水中的溶解度从氦到氡依次增大。
判断分子的熔沸点高低的方法
相对分子质量(越大)→范德华力(越大)→熔沸点(越高)如果两物质的相对分子质量相近,则看分子的极性。分子的极性(越大)→范德华力(越大)→熔沸点(越高) 例:将下列物质按熔沸点由高到低的顺序排列:D2O_____H2O I2_____Br2 CO_____N2CH4_____SiH4
范德华力是怎样影响分子的物理性质(如熔沸点)的?
固体→液体→气体的过程,熵值增大,分子间的距离不断被拉开,这个过程是分子吸收外界能量,克服范德华力某分子的范德华力如果越大,克服它就需要吸收外界更多的能量,因此只有外界温度较高时,分子才能顺利克服范德华力,实现固体→液体→气体的三态变化范德华力越大,则分子的熔沸点越高(与化学性质无关)
使原子(离子)结合的相互作用
把分子聚集在一起的作用力
化学键与范德华力的比较
已知卤素单质的熔点、沸点数据如下表所示
(1)分析上表,总结卤素单质熔点、沸点有什么变化规律?
提示:卤素单质的熔点、沸点随着相对分子质量的增大而升高。
(2)怎样解释卤素单质熔点、沸点的变化规律?
提示:由分子构成的物质的沸点取决于分子间作用力的大小,随着相对分子质量的增大,它们分子间的作用力逐渐增大,沸点逐渐升高。
1.组成和结构相似的分子,相对分子质量越大,范德华力越大,物质的熔、沸点就越高,如熔、沸点:CF4
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1)极性分子中不可能含有非极性键( )(2)一般极性分子中含有极性键( )(3)H2O、CO2、CH4都是非极性分子( )(4)HF的沸点较高,是因为H—F的键能很大 ( )
2.下列各组物质中,都是由极性键形成的极性分子的一组是( )A.CH4和Br2 B.NH3和H2OC.H2S和CCl4 D.CO2和HCl
解析:CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S都是由极性键形成的极性分子,Br2是由非极性键形成的非极性分子。
3.下列关于范德华力的叙述中,正确的是( )A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键B.范德华力与化学键的区别是作用力的强弱问题C.任何分子间在任意情况下都会产生范德华力D.范德华力非常微弱,故破坏分子间的范德华力不需要消耗能量
解析:范德华力的实质也是一种电性作用,但范德华力是分子间较弱的作用力,不是化学键,A错误;化学键是粒子间的强烈的相互作用,范德华力是分子间较弱的作用力,B正确;若分子间的距离足够远,则分子间没有范德华力,C错误;虽然范德华力非常微弱,但破坏它时也要消耗能量,D错误。
4.下列关于范德华力影响物质性质的叙述中,正确的是( )A.范德华力是决定由分子构成的物质的熔、沸点高低的唯一因素B.范德华力与物质的性质没有必然的联系C.范德华力能够影响物质的化学性质和物理性质D.范德华力仅影响物质的部分物理性质
解析:范德华力是一种分子间作用力,因此范德华力不会影响物质的化学性质,只影响物质的部分物理性质。
5.下列物质的变化中,破坏的主要是范德华力的是( )A.碘单质的升华B.NaCl溶于水C.将冰加热变为液态D.NH4Cl受热分解解析:碘升华只是状态发生了变化,破坏的是范德华力,没有破坏化学键;NaCl溶于水,会破坏离子键;冰由固态变为液态,破坏的主要是氢键;NH4Cl受热分解,破坏的是化学键(包括共价键和离子键)。
6.人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼如履平地的蜘蛛侠,现实中的蜘蛛能在天花板等比较滑的板面上爬行,蜘蛛之所以不能从天花板上掉下的主要原因是( )
A.蜘蛛脚的尖端锋利,能抓住天花板B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上C.蜘蛛脚上的大量细毛与天花板之间的范德华力这一“黏力”使蜘蛛不致坠落D.蜘蛛有特异功能,能抓住任何物体
解析:蜘蛛不能掉下的根本原因是蜘蛛脚上的大量细毛与天花板之间存在范德华力。
7.下列关于范德华力的叙述中,正确的是( )A.范德华力是化学键B.范德华力与化学键的强弱相同C.范德华力实质是一种静电引力D.范德华力非常微弱,故破坏范德华力不需要消耗能量
解析:范德华力是分子之间的一种相互作用,其实质也是一种电性作用,既包括静电引力,也包括静电斥力,但比较微弱,化学键是强烈的相互作用,故范德华力不是化学键,A、B、C错误;虽然范德华力非常微弱,但破坏它时也要消耗能量,D错误。]
高中化学人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质教课内容课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质教课内容课件ppt,文件包含23第一课时共价键的极性课后习题-新教材人教版2019高中化学选择性必修2docx、23第一课时共价键的极性课件-新教材人教版2019高中化学选择性必修2共35张PPTpptx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (2019)选择性必修2第三节 分子结构与物质的性质背景图ppt课件: 这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质背景图ppt课件,共42页。PPT课件主要包含了共价键的分类,共价键的极性,极性向量,极性的表示方法,HCl,非极性分子,极性分子,分子的极性,1单原子分子,2双原子分子等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二节 分子晶体与共价晶体教案配套ppt课件: 这是一份人教版 (2019)选择性必修2第二节 分子晶体与共价晶体教案配套ppt课件,共32页。PPT课件主要包含了共价晶体的概念,共价晶体,常见的共价晶体,典型共价晶体,金刚石,金刚石的结构特征,二氧化硅晶体,SiO2的结构特征,晶体类型相同,2分子晶体等内容,欢迎下载使用。













