






化学必修1第二节 化学计量在实验中的应用图文课件ppt
展开
这是一份化学必修1第二节 化学计量在实验中的应用图文课件ppt,共39页。PPT课件主要包含了讨论哪种方法简单,容量瓶,molL,配制步骤,托盘天平的使用,称量产生误差,定容时俯视刻度,定容时仰视刻度,定容误差,无影响等内容,欢迎下载使用。
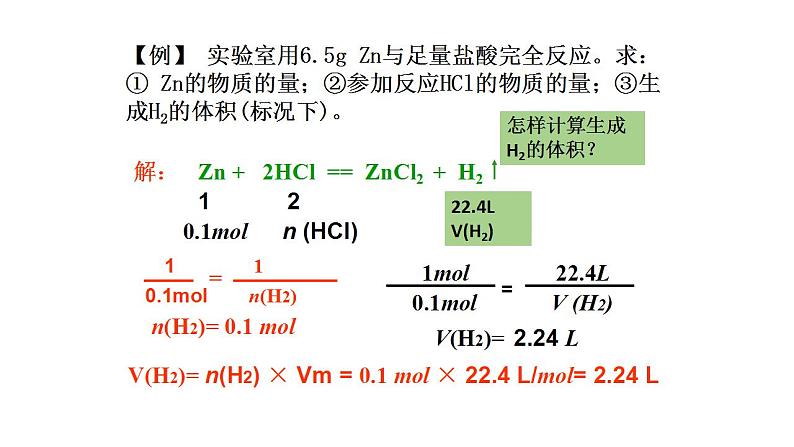
【例】 实验室用6.5g Zn与足量盐酸完全反应。求:① Zn的物质的量;②参加反应HCl的物质的量;③生成H2的体积(标况下)。
n(HCl)= 0.2 ml
m(HCl)= 7.3g
怎样计算生成H2的体积?
n(H2)= 0.1 ml
V(H2)= n(H2) × Vm = 0.1 ml × 22.4 L/ml= 2.24 L
总结:(1)化学方程式所表示的是实际参加反应的物质之间量的关系。(2)计算的基本步骤 ①设未知数 ②写出化学方程式。 ③写出已知、未知量 ④列出比例式求解x ⑤答(3)单位应上下一致。
例:与27.6k2CO3恰好完全反应的盐酸物质的量是多少?产生的气体在标况下的体积是多少?
实验室如何配制 100 g 10%的NaOH溶液?
如何配制 100 mL 含0.1ml NaOH的溶液?
请你从所提供的仪器中选择一种较精确的配制所需溶液,你为什么选择它?
精确配制一定体积溶液的仪器在外形上有什么特征?
容量(规格)温度 刻度线
常用规格:50mL 100mL 250mL 500mL 1000mL
提醒:回答容量瓶时一定要注明规格!!!
准确配制一定物质的量浓度的溶液
八、“物质的量浓度”的概念
CB = nB / V
单位体积的溶液里所含溶质B的物质的量
1 ml/L的NaCl溶液的含义是?
1 LNaCl溶液中含NaCl的物质的量是1ml。
②将10 g NaOH溶于水,配成100 mL溶液,c (NaOH)=2.5ml/L 。
③将1 L 10 ml/L的浓盐酸与9 L水混合,c (HCl)=1 ml/L 。
④将22.4 L HCl气体(标况下)通入1 L水中,c (HCl)=1 ml/L 。
⑥从1 L 1 ml/L的NaCl溶液中取出100 mL,取出溶液的浓度为0.1ml/L。
①将10 g NaOH溶于100 mL水中,c (NaOH)= 2.5ml/L 。
⑤将22.4 L HCl气体通入水中,配制成1 L溶液, c (HCl)=1 ml/L 。
⑦将6.2g Na2O溶于水配成一升溶液,所得溶液的浓度为0.1ml/L。
② 对于一定物质的量浓度的溶液,无论取出多少,浓度不变。
例1 将4gNaOH溶于水配成2L溶液,其物质的量浓度为多少?
例2 配制500mL0.1ml/LNaOH溶液,需要NaOH的质量是多少?
例3 配制480mL0.1ml/LNaOH溶液,需要NaOH的质量是多少?
由于无480ml的容量瓶,故只能准确配制500ml溶液,取480ml使用。
3、已知:H2SO4在水溶液中发生如下电离:H2SO4===2H++SO42-,则2L 1ml/L的H2SO4溶液,H+的物质的量浓度为______,SO42-的物质的量浓度为_________。
结论:在水中完全电离的化合物,电离出的离子浓度与该化合物浓度及化学式有关,与溶液体积无关。
4、下列各溶液中,Na+ 浓度最大的是 ( )A.4L 0. 5 ml/L NaCl 溶液 B.1L 0. 3 ml/L Na2SO4 溶液C. 0. 8L 0. 4 ml/L NaOH 溶液 D. 2L 0. 15 ml/L Na3PO4 溶液
5、在含有AlCl3、KCl、K2SO4三种溶质的溶液中,已知c(Cl-)=3.5ml/L、 c(K+)=1.5ml/L、 c(SO42- )=0.5ml/L, 求c(Al 3+) 。
结论:电荷守恒:溶液中阳离子所带电荷总数=阴离子所带电荷总数。
6、将等物质的量浓度的 NaCl、MgCl2、AlCl3溶液中的Cl- 恰好完全沉淀需要用等物质的量的 AgNO3 ,则消耗NaCl、MgCl2、AlCl3这三种溶液的体积比为( ) A 6:3:2 B 2:3:6 C 1:2:3 D 3:2:1
十、一定物质的量浓度溶液的配制
配制100 ml 1.00ml/L NaCl 溶液
配制100ml 1.00ml/L NaCl溶液,需要多少NaCl g?
解:m = n·M = c·V·M =1.00ml/L×0.1L×58.5g/ml =5.85g≈ 5.9g
1) 称量前,先调归零调平
2) 称量时,易潮解、有腐蚀的试剂应放在小烧杯中快速称量(例NaOH)
3) 称量时,左物右码。
若砝码和物品位置放反了,对所配溶液浓度的影响是什么?
用托盘天平称量固体溶质5.9g
因为物质溶解时常伴有放热或吸热现象,会使容量瓶体积变化,影响精确度。
将称量的溶质倒入小烧杯,加入适量的蒸馏水,用玻棒搅拌加速溶解,冷却至室温.
为何不直接在容量瓶中溶解?
容量瓶使用注意事项:不可溶解固体、稀释溶液,不可受热遇冷,不可做反应容器,不可储存溶液。
如何将烧杯中的液体转移到容量瓶中?
用玻棒引流,避免液体洒在瓶外。
将烧杯中冷却后的溶液转移到容量瓶
烧杯口紧靠玻璃棒;玻璃棒下端紧靠容量瓶刻度线以下;玻璃棒不靠容量瓶瓶口。
为什么要洗涤玻璃棒和烧杯?
保证溶质全部转移到容量瓶中
转移后,并用蒸馏水洗涤小烧杯和玻璃棒2-3次,将洗涤液一并注入容量瓶。
不洗涤玻璃棒和烧杯,不将洗涤液转入容量瓶中,所配溶液浓度怎么变化?
在容量瓶中继续加水至距刻度线1~2cm处,改用胶头滴管滴加至刻度(液体凹液面最低处与刻度线相切)。
定容时俯视刻度线,所配溶液浓度怎么变化?
定容时仰视刻度线,所配溶液浓度怎么变化?
把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒,混合均匀。
使用容量瓶前需要查漏吗?
如果摇匀后发现液面低于刻度线,怎么办?
属于正常现象,不能再加水!
再加水,所配溶液浓度会怎么变化?
注意:容量瓶不能保存溶液
将容量瓶中的溶液装到玻璃试剂瓶中,贴上标签,注明名称、浓度、配置日期。
量筒 烧杯 玻璃棒 100ml容量瓶 胶头滴管
十一、一定物质的量浓度溶液的配制
凡是使m 或n 减小的因素,都使c 偏小;
凡是使V 增大的因素,都使c 偏小;
凡是使V 减小的因素,都使c 偏大。
凡是使m 或n 增大的因素都使c 偏大;
称量物放错(右物左码):
2.转移:不小心将溶液溅出
忘记洗涤或未把洗涤液倒入容量瓶
5.定容时加水超了刻度线,用吸管吸出一部分:
热胀冷缩原理,冷却后溶液体积减小
7.摇匀后液面下降,又加水至刻度线:
属正常现象,不应再加水
8.洗涤容量瓶后,未干燥,瓶中有少量的蒸馏水:
2)称量时,物质和砝码放反,并使用游码
3)量筒量取液体药品时仰视读数
4)量筒量取液体药品时俯视读数
5)敞口称量NaOH时间过长
6)量筒量取液体后,冲洗量筒,并将冲洗液收入烧杯。
B、溶解、转移、洗涤产生误差
2)未洗涤溶解用的玻璃棒和烧杯
3)洗涤液未转入容量瓶中而倒入废液缸中
1)溶解过程中有少量液体溅出烧杯
4)容量瓶先用与所配溶液同浓度的溶液润洗
3) 定容时液面低于刻度线
4)未等溶液冷却就定容
5)定容后发现液面高于刻度线后,用滴管吸出少量溶液
6)摇匀后发现液面低于刻度再加水
1)容量瓶中含有少量的水
2)装瓶时,有液体流在试剂瓶外
c(浓溶液)·V(浓溶液)=c(稀溶液)·V稀溶液)
在稀释浓溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变,即在溶液稀释前后,溶液中溶质的物质的量相等。
在用浓溶液配制稀溶液时,常用下面的式子计算有关的量:
课本P17页第四题、P18页第七题
将5.3g Na2CO3固体配制成100mL溶液,取出10mL溶液加水稀释,稀释后的溶液浓度为0.1ml/L,求稀释后的溶液体积?
例:市售双氧水中溶质的质量分数为30%,密度为1.12 g·cm-3。计算市售双氧水中H2O2的物质的量浓度?
学会4个概念: 物质的量、摩尔质量、摩尔体积、物质的量浓度
相关课件
这是一份人教版 (2019)必修 第一册第三节 物质的量教学课件ppt,共20页。PPT课件主要包含了请看医院的体检单,学习目标,第5课时物质的量浓度,物质的量浓度等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量背景图ppt课件,共48页。PPT课件主要包含了第1章认识化学科学等内容,欢迎下载使用。
这是一份第2讲 物质的量浓度及一定物质的量浓度溶液的配制课件PPT,共56页。










