






人教版 (新课标)必修1第二节 化学计量在实验中的应用说课课件ppt
展开
这是一份人教版 (新课标)必修1第二节 化学计量在实验中的应用说课课件ppt,共59页。PPT课件主要包含了问题1,问题2,问题3,问题4,约30mL,约30g,数字太大,不便使用,如何化大为小,H2O分子总数等内容,欢迎下载使用。
本节课我们要理解以下几个量的概念及相关联系:1. 物质的量2. 摩尔3. 阿伏伽德罗常数4. 摩尔质量5.摩尔体积6.物质的量浓度
如何在超市里快速数出120瓶啤酒?
如何测量一张纸的厚度?
如何提高麻辣烫员工的结账速度?
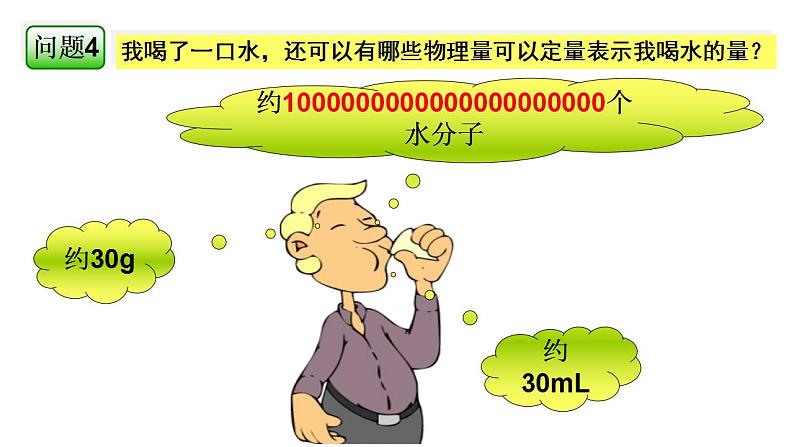
我喝了一口水,还可以有哪些物理量可以定量表示我喝水的量?
约1000000000000000000000个水分子
全球人1秒数1个,需要450万年才能数完!
0.012kg12C中所含碳原子数
已知:1个12C原子的质量约为:1.993X10-23g
6.02×1023/堆
(1000000000000000000000个)
6.02×1023/摩尔
微观粒子:原子、分子、离子、质子、中子、电子
规定:1ml任何粒子的粒子数叫阿伏伽德罗常数,符号为NA,通常用6.02×1023 ml-1表示。
一.“物质的量”的概念
表示含有一定数目粒子的集合体
注意:“物质的量”是一个物理量的全称!
二.“阿伏加德罗常数”的概念
单位物质的量的任何物质中包含该物质微粒的数目
是国际单位制七个基本物理量之一。
【计算】已知:1粒大米的质量是0.01g,请问1ml大米的质量是多少?
0.01×6.02×1023=6.02×1021g=6.02×1015 (吨)
2、表示微粒物质的量时,必须指明其名称、化学式。 如:1ml H 1ml H+ 1ml H2 1ml氢气 1ml 氢
1、只能描述微观粒子。
3、 物质的量的数值整数、小数均可。
一个比例关系n1︰n2=N1︰N2
1. 计算3.01×1023个水分子的物质的量。
2. 计算0.5mlH2约含有氢分子数目及氢原子数目。
3. NO气体中,原子的总数是3.01×1023个,那么NO的物质的量是多少?
4. 1ml硫酸分子约含有氧原子数目是多少?
5. 3.01×1024个CO2分子中,O原子的物质的量是多少?
6. a ml H2SO4中有b个氧原子,则阿伏加德罗常数可表示为____________。
7. 已知CO和CO2两种物质中所含氧原子个数比为1:1,则 CO和 CO2的物质的量比为______。
8. 1ml H2O中:有 ml H原子,含有 个 H原子,约含有 个 O原子,含有 ml 质子,含有 个质子,含有电子数为: 。9. 2.5ml SO42-中含有 ml S原子,约含有 个O原子,含有的质子的物质的量为: ,含有的电子数为 。
如何在实验室中取出1mlFe?
实验室中需要通过质量称取铁
需要知道1个Fe原子的质量
目前只知道1ml Fe相当于6.02 ×1023个Fe原子
1ml物质的质量到底有多大?
结论:1ml任何物质的质量以克为单位时,在数值上等于该微粒的相对质量。
(1) 1ml Cu原子质量是 。(2) CO2相对分子质量是 。(3) 1ml Cl- (氯离子)质量是 。(4) 1ml Na+(钠离子)质量是 。(5) 1ml NaCl质量是 。
三.“摩尔质量”的概念
单位物质的量的任何物质所具有的质量
以g/ml为单位时数值等于其相对原子质量或相对分子质量
1ml任何物质的质量(克)
(1)1mlCu质量是? (2)1mlO2摩尔质量是? (3) 1mlCO2相对分子质量是? (4) 2mlCO2质量是? (5)氢的摩尔质量是2g/ml? (6) Na+摩尔质量是23g/ml?
1、3.01×1023 个H2SO4的物质的量是: ,其质量是 ,含有 个 O原子。2、92g NO2含有 个NO2 分子,其中氧原子的质量是 ,含有的质子数为 。
3、现有以下四种物质:① 22 g 二氧化碳 ② 8 g 氢气③1.204×1024 个氮气分子 ④ 4℃时18 mL水请按要求为它们排序:(1)所含分子数由多到少: ;(2)所含原子数由多到少: ;(3)质量由大到小: ;(4)所含电子数由多到少: 。
4、某气体6.4 g, 含有6.02×1022个分子, 该气体的相对分子质量为 ( ) A. 32 B. 64 C. 64 g D. 64 g·ml-1
5、如果1 g 水中含有m 个氢原子,则阿伏加德罗常数值为 ( ) A.1/9m B.9m C.2m D.18m
6、相同物质的量的SO2和SO3比较:(1)它们所含的分子数之比为: ;(2)它们所含的原子数之比为: ;(3)它们所含的S原子数之比为: ;(4)它们所含的O原子数之比为: ;(5)它们的质量之比为: 。
64:80 = 4:5
7、相同质量的SO2和SO3比较:(1)它们所含的分子数之比为: ;(2)它们所含的原子数之比为: ;(3)它们所含的S原子数之比为: ;(4)它们所含的O原子数之比为: ;(5)它们的质量之比为: 。
如图为电解水的装置,你能判断出A、B气体分别是什么吗?你的依据是什么?
结论:在相同条件下,1ml氢气和1ml氧气的体积相同???
1ml物质的体积是多少?
在相同条件下,为什么1摩尔固体或液体的体积相差较大,而1摩尔气体的体积却几乎相同 ?
1.物质体积的大小取决于什么?
2.在微粒数目相同的情况下,固体、液体的体积主要由什么因素决定?
3.在微粒数目相同的情况下,气体体积主要由什么因素决定?
决定物质体积大小的三个因素
在微粒数目相同的情况下,固体、液体的体积主要由粒子本身的大小决定。
通常情况下,气体分子的平均距离是分子直径的10倍左右.
在微粒数量相同时,决定气体体积大小的主要是气体分子间的距离。
为什么在相同的温度和压强下,任何气体间的距离可以看成是相等的?
结论: 同温同压下,粒子数相同的任何气体都具有相同的体积。
同温同压下,气体分子间平均距离相等。
结论: 同温同压下,粒子数相同的任何气体 都具有相同的体积。
同温同压下,相同体积的任何气体都具有相同数目的粒子。
0℃ 101kP,1ml任何气体的体积约是22.4L
(1)任何条件下,1ml气体物质所占的体积约为22.4L
(2)标况下,二氧化氮的体积约为22.4L
(3)标况下,1ml任何物质所占的体积均约为22.4L
(4)标况下,1ml由N2和H2组成的混合气体的体积约为22.4L
(5)只有在标准状况下,1ml气体才约是22.4L
四.气体“摩尔体积”的概念
单位物质的量的任何气体所具有的体积
0℃ 101kP(标况), 气体的摩尔体积约是22.4L/ml。
在不同温度和压强下, 气体的摩尔体积可能不同。
可以是单一气体,也可是混合气体。
1. 标准状况下,气体的摩尔体积都约是22.4L。
2. 1ml气体的体积约为22.4L。
3. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
4. 2 gH2和44g CO2体积相等
5.若气体的摩尔体积是22.4L/ml,则一定处于标准状况下。
7. 常温常压,1ml H2的原子个数是2NA。
8.1摩尔水在标准状况下的体积约为22.4L。
提醒:在标况下不是气体的常见物质有:H2O, HF, SO3 ,CCl4 ,苯,乙醇等
(2×6.02×1023个=1.204 ×1024个)
标准状况下, 112 mL 某气体的质量为 0 . 14 g , 则其摩尔质量是多少?相对分子质量是多少?
= 0 . 005 ml
= 28 g / ml
标准状况下,O2的密度为?
N,n,m,V之间的相互转化
五、阿伏加德罗定律及推论:
1 、阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同数目的分子。
2、阿伏加德罗定律推论:
推论1、同温同压下 : 推论2、同温同容下:
推论3、同温同压下:
推论3、同温同压下:根据
1.在同温同压下,对于等质量的SO2和CO2两种气体,求其下列各项比值。(1)摩尔质量比 ;(2)密度比 ;(3)物质的量比 ;(4)体积比为 ;(5)分子数比 。
64:44 = 16:11
3、同温同压下,下列密度相同的气体组是 : A、CO、N2 B、NO、CH4 C、C2H4、NO D、SO2、Cl2
4、将H2、O2、N2三种气体分别装在三个容积相等的容器中,当温度和密度完全相同时,三种气体压强(P)的大小关系正确是( ) A、P(H2)=P(O2)=P(N2) B、P(H2)>P(N2)>P(O2)
C、P(H2)>P(O2) >P(N2) D、P(N2)>P(O2)>P(H2)
5、同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内的气体一定具有相同的( ) A、质量 B、原子总数 C、碳原子数 D、密度
6、一定温度下的密闭容器中,注入8ml NH3和3ml Cl2发生反应:8NH3+3Cl2 =N2+6NH4Cl。请问反应前后的压强比为 。
摩尔质量可以计量混合物吗?
【例】在标准状况下,由10 g CO和CO2组成的混合气体的体积为6.72 L,则此混合气体中CO和CO2的平均摩尔质量为_____________。
六、平均摩尔质量的计算
1. 氮气、二氧化碳以物质的量比2:3混合,求混合气体的平均摩尔质量。
2. 标况下,1 L Cl2、5 L O2、11 L H2 混合,求混合气体的平均摩尔质量 。
3、固体A加热发生如下反应: 2A(s)= B↑+ C↑+3D↑同温同压下,测得生成的混合气体对H2的相对密度为15,求M(A) = 。
4、二氧化碳和氧气的平均摩尔质量40g/ml,则二者的物质的量之比为?
相关课件
这是一份化学必修第一册摩尔质量 气体摩尔体积习题ppt课件,共8页。
这是一份高中化学沪科版(2020)必修第一册第1章 化学研究的天地物质的量摩尔质量 气体摩尔体积习题课件ppt,共3页。
这是一份高中第三节 物质的量课前预习ppt课件,共38页。PPT课件主要包含了012kg12C,g·mol-1,相对式量,题组训练,gmol,③②④①,结束放映,返回导航页,栏目导引等内容,欢迎下载使用。










