

所属成套资源:2022届高三化学一轮高考复习常考题型(共83份)
2022届高三化学一轮高考复习常考题型:42溶液酸碱性与PH
展开
这是一份2022届高三化学一轮高考复习常考题型:42溶液酸碱性与PH,共22页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
www.ks5u.com
2022届高三化学一轮高考复习常考题型:42溶液酸碱性与PH
一、单选题(共16题)
1.常温下,下列溶液一定呈碱性的是
A.能与金属铝反应放出氢气的溶液
B.的溶液
C.溶液中由水电离的c(H+)=1×10-12 mol/L
D.使紫色石蕊试液呈红色的溶液
2.下列溶液一定显酸性的是
①pH<7的溶液
②c(H+)=c(OH-)的溶液
③c(H+)=l×10-6mol/L的溶液
④c(H+)>c(OH-)的溶液
⑤25℃下0.1mol/LNaHSO3的溶液
⑥能使酚酞试液显无色的溶液
A.①③④⑤⑥ B.②④⑤⑥ C.⑤⑥ D.④⑤
3.如图三条曲线表示不同温度下水的离子积常数,下列说法不正确的是
A.图中温度:
B.点可能是显酸性的盐溶液
C.图中五点间的关系:
D.图中关系:
4.一定温度下,满足下列条件的溶液一定呈酸性的是( )
A.pH=6的某物质的水溶液 B.加酚酞后显无色的溶液
C.能与金属Al反应放出H2的溶液 D.c(H+)>c(OH-)的任意物质的水溶液
5.物质的量浓度相同的下列溶液,pH由大到小排列正确的是
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3•H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、CH3COOH、C2H5OH、HCl
6.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡时pH值随溶液体积变化的曲线如图所示。据图判断正确的是
A.II为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.稀释前盐酸的物质的量浓度大于醋酸的物质的量浓度
7.两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是
A.MOH是一种弱碱
B.在x点,c(M+)>c(R+)
C.稀释前,c(ROH)<10c(MOH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的10倍
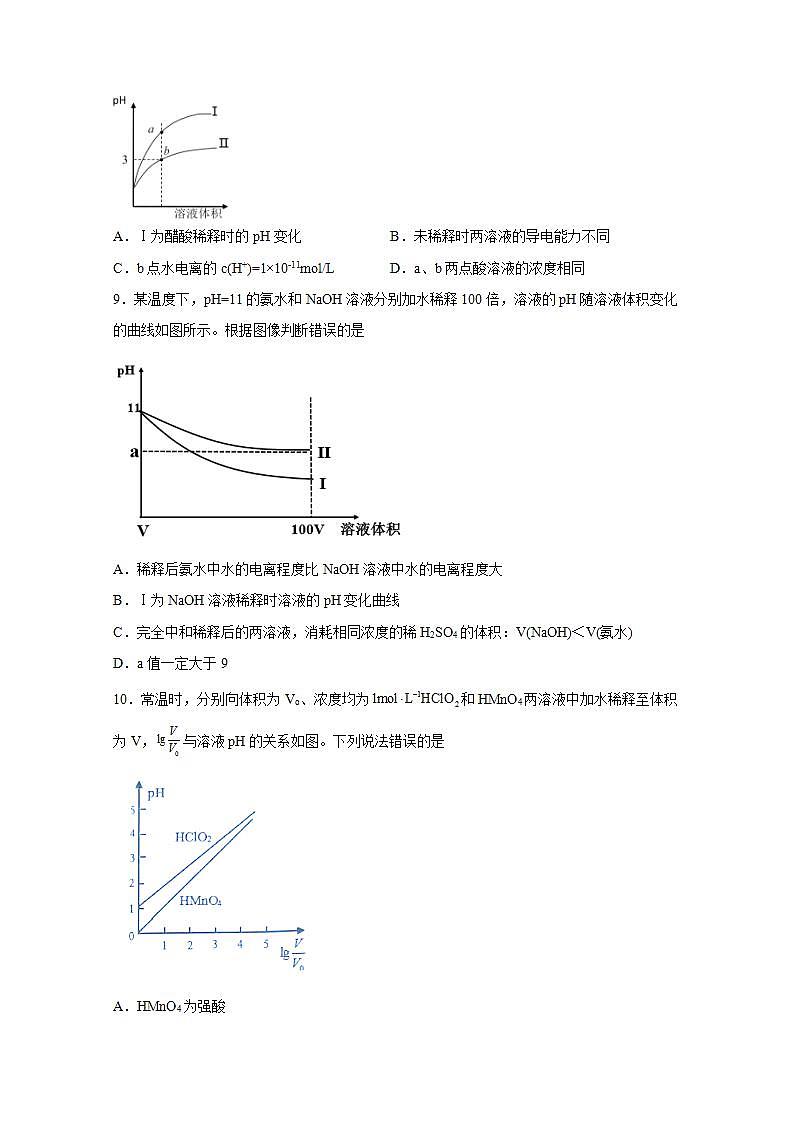
8.25℃,相同pH、相同体积的盐酸和醋酸溶液分别加水稀释,pH随溶液体积的变化如图所示。下列判断正确的是
A.Ⅰ为醋酸稀释时的pH变化 B.未稀释时两溶液的导电能力不同
C.b点水电离的c(H+)=1×10-11mol/L D.a、b两点酸溶液的浓度相同
9.某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断错误的是
A.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
B.Ⅰ为NaOH溶液稀释时溶液的pH变化曲线
C.完全中和稀释后的两溶液,消耗相同浓度的稀H2SO4的体积:V(NaOH)<V(氨水)
D.a值一定大于9
10.常温时,分别向体积为Vo、浓度均为和HMnO4两溶液中加水稀释至体积为V,与溶液pH的关系如图。下列说法错误的是
A.HMnO4为强酸
B.当两溶液均稀释至pH=3时,
C.在0≤pH≤5时,HMnO4溶液满足:
D.稀释前分别用1mol·L-1的NaOH溶液中和两种酸至中性,消耗的n(NaOH)相同
11.某温度下,相同pH值得盐酸和醋酸溶液分别加水稀释。pH值随溶液体积变化变化如图所示。据图判断正确的是
A.Ⅱ为盐酸稀释时pH值变化曲线
B.b点酸的总浓度小于a点酸的总浓度
C.两种酸的物质的量浓度一定相等
D.a点Kw的数值比b点Kw的数值大
12.常温下,甲酸和乙酸的电离常数分别为1.8×10-4和1.8×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。两种酸用通式HY表示,下列叙述正确的是
A.曲线Ⅱ代表乙酸
B.酸的电离程度:c点>d点
C.溶液中水的电离程度:b点>c点
D.从c点到d点,溶液中 保持不变
13.常温时,的和的两种酸溶液,起始时的体积均为,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是
A.在时,溶液满足
B.当稀释至pH均为3时,溶液中
C.稀释前分别用的NaOH溶液中和,消耗的NaOH溶液体积:
D.常温下,浓度均为的和溶液的
14.分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如图所示,其中正确的是
A.①③ B.②④ C.①②③ D.①②③④
15.室温下,pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法中正确的是
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.若A、B都是弱酸,则6>a>2
D.当a=5时,A是强酸,B是弱酸
16.常温下pH均为2的两种酸溶液X和Y各10 mL分别加水稀释到10000 mL,其pH与所加水的体积变化如图所示,下列结论中正确的是
A.加水后,Y酸的电离度增大
B.X酸在水溶液中存在电离平衡
C.加水后,X酸的电离平衡常数减小
D.X酸的物质的量浓度与Y酸的物质的量浓度相等
二、填空题(共6题)
17.I.常温下,向100mL0.01mol·L-1的HA溶液中逐滴加入0.02mol·L- 1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。
(1)由图中信息可知HA为___(填“强”或“弱”)酸。
(2)常温下一定浓度的MA稀溶液的pH=a,则a___(填“>”“<”或“=”)7,用离子方程式表示其原因:___,此时,溶液中由水电离出的c(OH- )=___(用含a的代数式表示)。
(3)K点对应的溶液中,c(M+)+c(MOH)___(填“>”、“<”或“=”)2c(A- );若此时溶液的pH=10,则c(MOH)+c(OH- )=___mol·L- 1。
Ⅱ.室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___点;在b点,溶液中各离子浓度由大到小的排列顺序是___。
18.(1)写出铝与氢氧化钾溶液反应的离子方程式___________。
(2)液氨中存在自耦电离,类似水的电离,写出液氨自耦电离方程式___________。
(3)比较给出能力的相对强弱:___________,(填“>”“”“”、“ c(H+),溶液显碱性,故B错误;
C.温度越高,水的离子积越大,A、B、C三点温度相同,所以这三点水的 离子积是一样的,E点对应T3,D第点对应T2,,所以水的离子积,故C正确;
D.根据图像可知,B、D、E三点的c(H+)=110-6mol/L,故,故D正确;
本题答案B。
4.D
【详解】
A. 在室温下中性溶液pH=7,pH=6的溶液为酸性溶液,但由于未指明溶液的温度,因此不能确定该溶液是否显酸性,A不选;
B. 酚酞的pH变色范围是8.2~10.0,所以加入酚酞后显无色的溶液可能显酸性,也可能显中性或碱性,不一定呈酸性,B不选;
C.Al既能与酸反应产生氢气,也能与强碱溶液反应产生氢气,因此不能根据与金属Al反应放出H2确定溶液是否显酸性,C不选;
D.在任何物质的稀溶液中都存在水的电离平衡,若溶液中c(H+)=c(OH-),溶液显中性;若c(H+)>c(OH-),溶液显酸性;若c(H+)c(OH-)确定该溶液一定呈酸性,D选;
故合理选项是D。
5.B
【详解】
A.FeCl3是强酸弱碱盐,Fe3+水解溶液呈酸性,KCl是强碱强酸盐溶液,呈中性,pH值较大应是KCl,正确的顺序为Ba(OH)2、Na2SO3、KCl、FeCl3,故A错误;
B.SiO32-和CO32-是弱酸酸根,水解会使溶液显碱性,酸性越弱,水解程度更强,碳酸的酸性强于硅酸,则等物质的量浓度下,Na2SiO3溶液的pH值较大,而KNO3溶液呈中性,NH4+水解使NH4Cl溶液显酸性,pH值大小排序正确,故B正确;
C.H3PO4显酸性,Na2SO4为中性,pH值较大应是Na2SO4,故C错误;
D.C2H5OH呈中性,CH3COOH呈酸性,pH值较大应是C2H5OH,故D错误;
答案选B。
6.B
【分析】
醋酸是弱酸,不完全电离,盐酸是强酸,在水溶液中完全电离,加等量的水稀释,盐酸溶液的pH变化大于醋酸溶液的pH变化,因此Ⅰ为盐酸的pH变化曲线,Ⅱ为醋酸的pH变化曲线。
【详解】
A.根据分析可知,II为醋酸稀释时的pH值变化曲线,故A错误;
B.b点溶液的离子浓度比c点溶液的离子浓度大,b点溶液的导电性比c点溶液的导电性强,故B正确;
C.Kw只和温度有关,温度不变,Kw不变,则a点Kw的数值和c点Kw的数值相等,故C错误;
D.稀释前盐酸和醋酸的pH相同,即二者溶液中电离出的氢离子浓度相同,但醋酸是弱电解质,部分电离,则盐酸的物质的量浓度小于醋酸的物质的量浓度,故D错误;
答案选B。
7.B
【详解】
A.根据强碱稀释10n,pH变化n个单位,由图像可知MOH为弱碱,ROH为强碱,故A正确;
B.在x点,c(OH-)=c(M+)+c(H+)=c(R+)+c(H+),x点时MOH和ROH溶液中c(H+)均为10−11 mol·L−1,c(OH-)均为10−3 mol·L−1,故c(M+)=c(R+),故B错误;
C.MOH为弱碱,ROH为强碱,稀释前c(ROH)=0.1 mol·L−1,MOH部分电离,c(MOH)>0.01 mol·L−1,因此稀释前c(ROH)<10c(MOH),故C正确;
D.稀释前MOH溶液中由水电离出的c(OH-)=10−12 mol·L−1,ROH溶液中由水电离出的c(OH-)=10−13 mol·L−1,前者是后者的10倍,故D正确。
综上所述,答案为B。
8.C
【详解】
A.由于稀释过程中CH3COOH能继续电离产生H+,而盐酸稀释前已经完全电离,故稀释相同倍数后,CH3COOH中c(H+)大于盐酸中c(H+),但pH:CH3COOHa>2,故C错误;
D、A、B两种酸分别稀释1000倍,强酸中不存在电离平衡,因此c(H+)变为原溶液的1/1000,即pH增大3个单位,若a=5,则A是强酸;而弱酸中存在电离平衡,稀释时电离平衡正向移动,导致c(H+)减小程度小于稀释的倍数,即pH的增大小于3个单位,从图中可知B稀释后pH小于a,所以B为弱酸,故D正确;
综上所述,本题应选D。
16.B
【解析】
【详解】
pH均为2的两种酸,如果酸是强酸,稀释1000倍后,溶液的pH应该为5,如果是弱酸,因为存在电离平衡,导致稀释后的溶液中氢离子大于原来的,则溶液的pH应该大于2小于5,根据图象知,溶液稀释后,Y的pH为5,X的小于5,所以Y是强酸,X是弱酸;
A.通过以上分析知,Y是强酸,不存在电离平衡,故A错误;
B.X是弱酸,在水溶液中存在电离平衡,故B正确;
C.电离平衡常数只与温度有关,温度不变,电离平衡常数不变,故C错误;
D.pH相等的强酸和弱酸,弱酸的物质的量浓度大于强酸的物质的量浓度,故D错误;
故选:B。
17.强 < M++H2O⇌MOH+H+ 1×10-amol•L-1 = 0.005 a c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)
【分析】
根据图象的起点时酸的浓度和溶液的pH判断酸的强弱;根据N点消耗的碱的体积与溶液的pH判断出MOH的碱性强弱,再判断MA稀溶液的酸碱性,结合电荷守恒和物料守恒分析解答;室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,氢氧化钠先与氢离子反应,再与铵根离子反应;根据图象,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4; b、c、d三点溶液中均含有NH3•H2O;b点溶液呈中性,溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,结合a点溶液中有等浓度的(NH4)2SO4与Na2SO4分析解答。
【详解】
I.(1)根据图象知,0.01mol•L-1HA溶液中pH=2,氢离子浓度等于酸的浓度,所以该酸是一元强酸,故答案为:强;
(2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显酸性,即a<7;原因是M+离子结合水电离的氢氧根离子生成了MOH,离子方程式为M++H2O⇌MOH+H+;MA稀溶液氢离子全部由水电离,则常温下一定浓度的MA稀溶液的pH=a,由水电离出的c(OH-)=水电离出的c(H+)=1×10-amol•L-1;故答案为:<;M++H2O⇌MOH+H+;1×10-amol•L-1;
(3)HA是强酸,所以K点对应的溶液中,c(A-)=×0.01mol•L-1=0.005mol•L-1,故c(M+)+c(MOH)=2c(A-)=0.01mol/L;根据电荷守恒可得:c(H+)+c(M+)=c(A-)+c(OH-),由c(M+)+c(MOH)=0.01mol/L可得,c(M+)=0.01mol/L-c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L-c(MOH)=c(A-)+c(OH-),整理可得:c(MOH)+c(OH-)=c(H+)+0.01mol/L-c(A-)=10-10mol/L+0.01mol/L-0.005mol•L-1≈0.005mol•L-1,故答案为:=;0.005;
Ⅱ.室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,氢氧化钠先与氢离子反应,再与铵根离子反应;根据图象,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,(NH4)2SO4水解,溶液显酸性,pH<7; b、c、d三点溶液中均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离,因此水的电离程度最大的是a点;b点溶液呈中性,c(OH-)=c(H+),溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点溶液中有等浓度的(NH4)2SO4与Na2SO4, c(Na+)=c(SO42-)= c(NH)+ c(NH3•H2O),b点时c(Na+)>c(SO), c(SO)>c(NH),故c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+),故答案为:a;c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。
18. >
【详解】
(1)铝与氢氧化钾溶液反应生成偏铝酸钾、氢气和水,配平方程式为:,故答案为:;
(2)水电离生成H3O+和OH-叫做水的自偶电离,同水一样,液氨也有自偶电离,其自偶电离的方程式为:; 故答案为:;
(3)比较与给出H+的能力,可将二者放在同一反应中,利用反应中表现出的性质,判断二者的相对强弱。由反应可知,的酸性强于,从而得出给出H+的能力:>;该反应也可说明结合H+的能力比强,则表示二者结合H+能力相对强弱的化学方程式为:NaAlO2+ NaHCO3+H2O=Al(OH)3↓+Na2CO3。答案为:>;NaAlO2+ NaHCO3+H2O=Al(OH)3↓+Na2CO3;
(4)①电离平衡常数CH3COOH>H2CO3>HCN>HCO,等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3>NaCN>CH3COONa,故答案为:B>A>C;
②NaCN和少量CO2反应生成NaHCO3、HCN,反应离子方程式为,故答案为:。
19.< 11
【详解】
(1)①根据水在不同温度下的电离平衡曲线,可以计算出相应的Kw值。曲线a的Kw==10-710-7=10-14;曲线b的Kw==10-610-6=10-12;升高温度,促进水的电离,则Kw增大。因此曲线a和曲线b对应的温度关系为Ta
相关试卷
这是一份专题复习 高考化学 考点45 溶液的酸碱性及pH 讲义,共15页。试卷主要包含了溶液的酸碱性与pH,溶液的酸碱性及pH的计算,溶液稀释时pH的变化规律等内容,欢迎下载使用。
这是一份2024届高三化学一轮复习培优--溶液的酸碱性与pH训练,共21页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
这是一份2024届高三化学一轮复习(小题训练)--溶液的酸碱性与pH,共18页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。









