
2022版高考化学选考山东专用一轮总复习集训:专题二十气体的制备实验方案的设计与评价 模块卷
展开
这是一份2022版高考化学选考山东专用一轮总复习集训:专题二十气体的制备实验方案的设计与评价 模块卷,共8页。
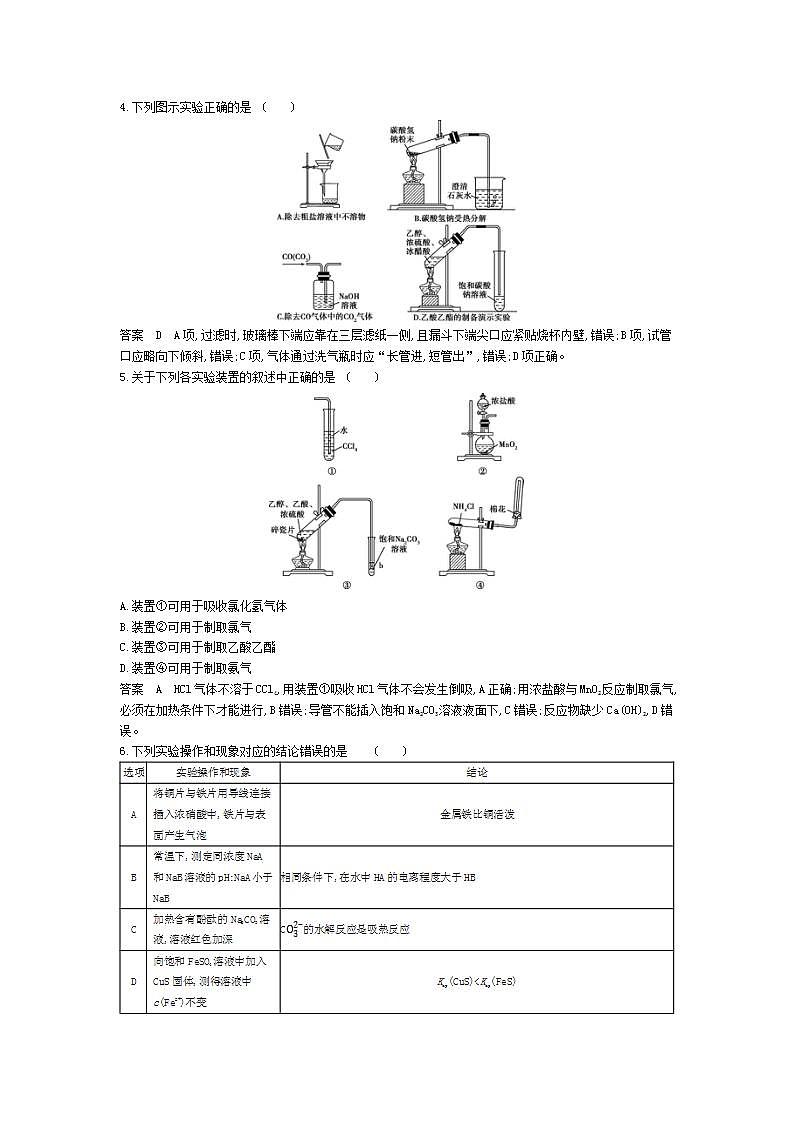
【模块卷】时间:30分钟 分值:42分一、选择题(每小题2分,共18分)1.下列有关实验的选项正确的是 ( )A.配制0.10 mol/L NaOH溶液B.观察Fe(OH)2的生成C.除去氯气中的氯化氢D.记录滴定终点读数为12.20 mL答案 B 定容时应平视刻度线,图中为俯视,A错误;植物油隔绝空气,可防止氢氧化亚铁被氧化,B正确;二者均与碳酸氢钠反应,应选饱和食盐水,C错误;滴定管的0刻度在上方,图中读数为11.80 mL,D错误。关联知识 Cl2+H2OHCl+HClO,HCl与NaHCO3溶液反应,平衡正向移动。2.CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为SO2+2CuSO4+2NaBr+2H2O2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是 ( )A.用装置甲制取SO2B.用装置乙制取CuBrC.用装置丙避光将CuBr与母液分离D.用装置丁干燥CuBr答案 D Na2SO3+H2SO4(浓)Na2SO4+H2O+SO2↑,装置乙中玻璃球泡可使SO2与CuSO4、NaBr混合液充分反应,用装置丙避光过滤可得到CuBr,用装置丁在空气中加热烘干CuBr会导致CuBr分解或加快其转化为浅绿色固体的速率。故A、B、C均可达到实验目的,D不能达到实验目的。3.下列图示对应的实验操作不合理的是 ( )答案 A 灼烧海带应该用坩埚,A不正确;K2Cr2O7溶液有强氧化性,用酸式滴定管盛装,B正确;粗盐水含泥沙,C正确;浓硫酸稀释时放热,需用玻璃棒不断搅拌,D正确。4.下列图示实验正确的是 ( )答案 D A项,过滤时,玻璃棒下端应靠在三层滤纸一侧,且漏斗下端尖口应紧贴烧杯内壁,错误;B项,试管口应略向下倾斜,错误;C项,气体通过洗气瓶时应“长管进,短管出”,错误;D项正确。5.关于下列各实验装置的叙述中正确的是 ( )A.装置①可用于吸收氯化氢气体B.装置②可用于制取氯气C.装置③可用于制取乙酸乙酯D.装置④可用于制取氨气答案 A HCl气体不溶于CCl4,用装置①吸收HCl气体不会发生倒吸,A正确;用浓盐酸与MnO2反应制取氯气,必须在加热条件下才能进行,B错误;导管不能插入饱和Na2CO3溶液液面下,C错误;反应物缺少Ca(OH)2,D错误。6.下列实验操作和现象对应的结论错误的是 ( )选项实验操作和现象结论A将铜片与铁片用导线连接插入浓硝酸中,铁片与表面产生气泡金属铁比铜活泼B常温下,测定同浓度NaA和NaB溶液的pH:NaA小于NaB相同条件下,在水中HA的电离程度大于HBC加热含有酚酞的Na2CO3溶液,溶液红色加深C的水解反应是吸热反应D向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变Ksp(CuS)<Ksp(FeS)答案 A 铁片遇浓硝酸会钝化,因此将铜片与铁片用导线连接插入浓硝酸中,铜片作负极,铁片作正极,无法得出铁比铜活泼的结论,A错误;A-的水解程度小于B-,说明HA酸性强于HB,相同条件下,在水中HA的电离程度大于HB,B正确;升温使C水解程度增大,溶液碱性增强,说明C水解反应是吸热反应,C正确;Fe2+浓度不变说明CuS没有转化为FeS,则Ksp(CuS)<Ksp(FeS),D正确。7.下列实验操作、现象和结论均正确的是 ( )选项实验操作现象结论A向某溶液中滴加H2O2溶液,再滴加KSCN溶液溶液变成血红色原溶液一定含Fe2+B向H2S溶液中通入O2溶液变浑浊氧化性:O2>SC向等浓度的NaHCO3溶液和 Na2CO3溶液中分别滴加2滴酚酞试液后者红色更深水解程度:NaHCO3>Na2CO3D向1 mol·L-1 Na2S溶液中滴加0.1 mol·L-1 ZnSO4溶液至不再产生沉淀,继续滴加0.1 mol·L-1 CuSO4溶液白色沉淀变为黑色Ksp(CuS)>Ksp(ZnS)答案 B 原溶液若含有Fe3+会出现同样的现象,A不正确;氧化剂的氧化性强于氧化产物的氧化性,B正确;由现象得出的结论是水解程度:Na2CO3>NaHCO3,C不正确;ZnS转化为CuS,说明Ksp(CuS)<Ksp(ZnS),D不正确。拓展延伸 D项中若要证明ZnS可以转化为CuS,则必须保证生成ZnS后S2-不能剩余。8.下列实验操作能达到实验目的的是 ( ) 实验目的实验操作A制备Al2S3固体AlCl3溶液与Na2S溶液反应,过滤B判断HCOOH是弱酸测定HCOONa溶液的酸碱性C干燥SO2气体将SO2气体通过盛有碱石灰的U形管D分离乙酸乙酯和碳酸钠溶液用长颈漏斗分离碳酸钠溶液和乙酸乙酯答案 B Al3+与S2-在水溶液中发生反应生成Al(OH)3和H2S,通常用铝粉和硫粉共热制备Al2S3固体,A项错误;测定HCOONa溶液呈碱性,可推知HCOOH是弱酸,B项正确;SO2是酸性氧化物,能与碱石灰反应,故不能用碱石灰干燥,C项错误;长颈漏斗不能用来分液,D项错误。9.将0.2 mol/L的KI溶液和0.05 mol/L Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-2Fe2++I2的是 ( )A.向混合液中滴入淀粉溶液,溶液变蓝色B.向混合液中滴入KSCN 溶液,溶液变红色C.向混合液中滴入AgNO3溶液,有黄色沉淀生成D.向混合液中滴入K3[Fe(CN)6]溶液,有蓝色沉淀生成答案 B 可逆反应中反应物均不能完全反应,通过理论计算可知该反应中I-过量,若Fe3+在反应后的溶液中存在,可证明该反应为可逆反应,故B正确。 二、非选择题(共24分)10.(14分)硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等,有关物质的部分性质如下表:物质熔点/℃沸点/℃其他性质SO2Cl2-54.169.1①易水解,产生大量白雾②易分解:SO2Cl2 SO2↑+Cl2↑H2SO410.4338吸水性且不易分解实验室用于干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:(1)仪器A冷却水的进水口为 (填“a”或“b”)。 (2)仪器B中盛放的药品是 ,其目的是 。 (3)实验时,装置丁中发生反应的离子方程式为 ,当生成6.72 L的氯气(标准状况下),转移电子的物质的量为 。 (4)装置丙盛放的试剂是 ,若缺少装置乙,对实验造成的影响是 。 (5)少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H H2SO4+SO2Cl2,从分解产物中分离出硫酰氯的操作是 。 答案 (1)a (2)碱石灰 吸收尾气并防止空气中水蒸气进入反应装置导致产品水解 (3)Cl+5Cl-+6H+ 3Cl2↑+3H2O 0.5 (4)饱和氯化钠溶液 SO2Cl2发生水解 (5)蒸馏解析 (2)产品SO2Cl2易水解,应避免与水蒸气接触;尾气中含有SO2和Cl2。(3)。(4)丙中试剂应除去Cl2中的HCl气体;乙装置为Cl2的干燥装置。(5)SO2Cl2与H2SO4沸点差别较大,故蒸馏H2SO4和SO2Cl2的混合物可分离出SO2Cl2。规律技巧 凡是收集易吸水或易水解的药品的装置,其后必连接隔绝水蒸气的装置。11.(10分)古代硫酸的制法是隔绝空气煅烧绿矾(FeSO4·7H2O),将蒸气冷却可制得一种无色黏稠的液体“绿矾油”,剩余的固体为红棕色。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃,在加热条件下SO3具有比较强的氧化性。完成下列各题:(1)“绿矾油”中溶质的化学式为 。 (2)用如图所示装置煅烧绿矾并检验气体产物,煅烧一段时间后,发现D中U形管内出现无色黏稠的液体,B中品红溶液褪色。①上述装置正确的连接顺序是A→ (用大写字母表示)。 ②写出煅烧绿矾的化学方程式: 。 (3)绿矾在空气中部分被氧化为硫酸铁,现取3.66 g绿矾样品溶于稀盐酸,加入足量的BaCl2溶液,过滤得沉淀4.66 g,向溶液中通入56 mL(标准状况)氯气恰好将Fe2+完全氧化,计算变质后的绿矾晶体中n(Fe3+)∶n(Fe2+)为 。 答案 (1)H2SO4(2分)(2)①D→E→B→C(2分)②2FeSO4·7H2O Fe2O3+SO3↑+SO2↑+14H2O↑(或 2FeSO4·7H2O Fe2O3+H2SO4+SO2 ↑+13H2O↑)(3分)(3)2∶1(3分)解析 (1)古代硫酸的制法是隔绝空气煅烧绿矾(FeSO4·7H2O),将蒸气冷却可制得一种无色黏稠的液体“绿矾油”,剩余的固体为红棕色,可知生成氧化铁、SO3与水(SO3与水反应生成硫酸),所以“绿矾油”中溶质的化学式为H2SO4。(2)①品红溶液检验SO2,氢氧化钠溶液吸收SO2以防污染,E是安全瓶,防倒吸,正确的连接顺序是A→D→E→B→C。②根据氧化还原反应的规律,铁元素化合价升高,硫元素化合价降低,所以还有SO2生成,根据原子守恒、得失电子守恒可得煅烧绿矾的化学方程式为2FeSO4·7H2O Fe2O3+SO3↑+SO2↑+14H2O↑或2FeSO4·7H2O Fe2O3+H2SO4+SO2↑+13H2O↑。(3)设硫酸根离子的物质的量为x mol,亚铁离子的物质的量为y mol,则有Ba2++ S BaSO4↓ 1 mol 1 mol x mol mol2Fe2++Cl2 2Fe3++2Cl-2 mol 1 moly mol mol则=,=解得x=0.02,y=0.005,根据电荷守恒得3n(Fe3+)+2n(Fe2+)=2n(S),则n(Fe3+)= mol=0.01 mol,n(Fe3+)∶n(Fe2+)=2∶1。
相关试卷
这是一份山东专用高考化学一轮复习专题二十气体的制备实验方案的设计与评价专题综合检测含解析,共19页。
这是一份山东专用高考化学一轮复习专题二十气体的制备实验方案的设计与评价_模拟集训含解析,共119页。
这是一份2022版高考化学选考山东专用一轮总复习集训:基本概念 模块卷,共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。









