

2022版高考化学选考山东专用一轮总复习集训:专题八化学键分子结构与性质 —模拟
展开
这是一份2022版高考化学选考山东专用一轮总复习集训:专题八化学键分子结构与性质 —模拟,共40页。
专题八 化学键 分子结构与性质
【5年高考】
考点一 化学键、电子式
1.(2019浙江4月选考,7,2分)下列表示不正确的是 ( )
A.次氯酸的电子式H:Cl····:O····:
B.丁烷的球棍模型
C.乙烯的结构简式CH2CH2
D.原子核内有8个中子的碳原子 614C
答案 A
2.(2018江苏单科,2,2分)用化学用语表示NH3+HClNH4Cl 中的相关微粒,其中正确的是 ( )
A.中子数为8 的氮原子:78N B.HCl 的电子式:H+[:Cl····:]-
C.NH3的结构式: D.Cl-的结构示意图:
答案 C
3.(2019上海选考,3,2分)下列反应只需破坏共价键的是 ( )
A.晶体硅熔化 B.碘升华
C.熔融Al2O3 D.NaCl溶于水
答案 A
4.(2019上海选考,11,2分)关于离子化合物NH5(H有正价和负价),下列说法正确的是 ( )
A.N为+5价
B.阴、阳离子个数比是1∶1
C.阴离子为8电子稳定结构
D.阳离子的电子数为11
答案 B
5.(2019浙江4月选考,18,2分)下列说法不正确的是 ( )
A.纯碱和烧碱熔化时克服的化学键类型相同
B.加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏
C.CO2溶于水和干冰升华都只有分子间作用力改变
D.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
答案 C
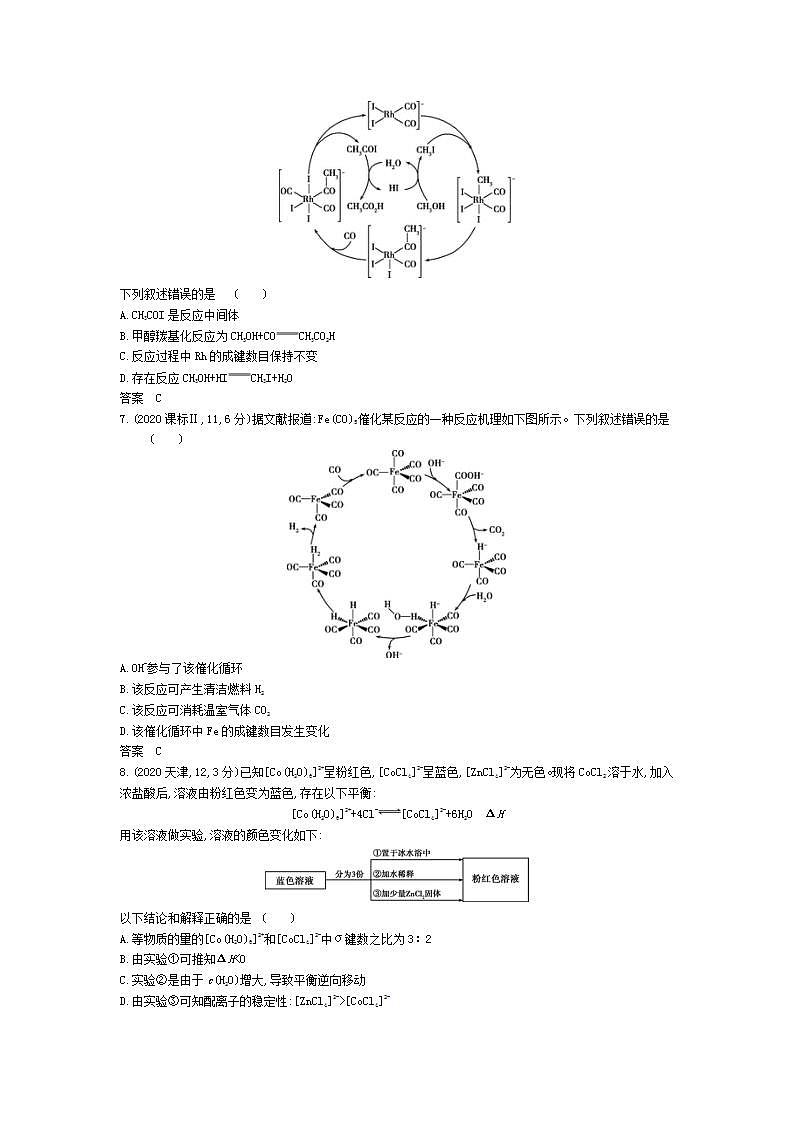
6.(2020课标Ⅰ,10,6分)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是 ( )
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+COCH3CO2H
C.反应过程中Rh的成键数目保持不变
D.存在反应CH3OH+HICH3I+H2O
答案 C
7.(2020课标Ⅱ,11,6分)据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是 ( )
A.OH-参与了该催化循环
B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2
D.该催化循环中Fe的成键数目发生变化
答案 C
8.(2020天津,12,3分)已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O ΔH
用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是 ( )
A.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中σ键数之比为3∶2
B.由实验①可推知ΔH[CoCl4]2-
答案 D
9.(2019海南单科,13,9分)自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(1)2016年IUPAC确认了四种新元素,其中一种为Mc,中文为“镆”。元素Mc可由反应 95243Am+2048CaMc+301n得到。该元素的质子数为 ,287Mc与288Mc互为 。
(2)Mc位于元素周期表中第ⅤA族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式: ,该分子内存在的共价键类型有 。
(3)该族中的另一元素P能呈现多种化合价,其中+3价氧化物的分子式为 ,+5价简单含氧酸的分子式为 。
答案 (1)115 同位素
(2)H··N··H····N··H····H 极性键和非极性键
(3)P2O3 H3PO4
10.(2018海南单科,13,8分)X、Y、Z为短周期元素,X原子的质子数等于Z与Y的质子数之和;Z与Y位于同一周期,Y原子核外有3个未成对电子,非金属Z的一种固体单质可导电。回答下列问题:
(1)Y在周期表中的位置是第 周期、第 族,其原子结构示意图为 ;Y与Z之间形成的化学键属于 。
(2)X、Y、Z三种元素中原子半径最大的是 (填元素符号);X单质既可与盐酸反应,又可溶于氢氧化钠溶液,产生的气体为 (填分子式),该气体与Y单质反应的化学方程式为 。
(3)Z最高价氧化物的电子式为 。
答案 (1)二 ⅤA (极性)共价键
(2)Al H2 N2+3H22NH3
(3)O········C····O····
考点二 分子的空间结构与分子性质
11.(2019上海选考,9,2分)下列说法错误的是 ( )
A.含有共价键的化合物是共价化合物
B.含有极性键的分子可能是非极性分子
C.有电子转移的反应是氧化还原反应
D.水溶液中能完全电离的电解质是强电解质
答案 A
12.(2020江苏单科,21A,12分)以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。
(1)Fe基态核外电子排布式为 ;[Fe(H2O)6]2+中与Fe2+配位的原子是 (填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是 ;C、N、O元素的第一电离能由大到小的顺序为 。
(3)与NH4+互为等电子体的一种分子为 (填化学式)。
(4)柠檬酸的结构简式见下图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为 mol。
答案 (1)[Ar]3d64s2或1s22s22p63s23p63d64s2 O
(2)sp3 N>O>C (3)CH4或SiH4 (4)7
13.(2020浙江7月选考,26,4分)(1)气态氢化物热稳定性HF大于HCl的主要原因是 。
(2)CaCN2是离子化合物,各原子均满足8电子稳定结构,CaCN2的电子式是 。
(3)常温下,在水中的溶解度乙醇大于氯乙烷,原因是 。
答案 (1)原子半径FCl—H
(2)Ca2+[N········C····N····]2-
(3)乙醇与水之间形成氢键而氯乙烷没有
14.(2019课标Ⅲ,35,15分)磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是 ,该元素基态原子核外M层电子的自旋状态 (填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的FeCl3的结构式为 ,其中Fe的配位数为 。
(3)苯胺()的晶体类型是 。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是 。
(4)NH4H2PO4中,电负性最高的元素是 ;P的 杂化轨道与O的2p轨道形成 键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
这类磷酸根离子的化学式可用通式表示为 (用n代表P原子数)。
答案 (1)Mg 相反
(2) 4
(3)分子晶体 苯胺分子之间存在氢键
(4)O sp3 σ
(5)(PnO3n+1)(n+2)-
15.(2019江苏单科,21A,12分)Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)Cu2+基态核外电子排布式为 。
(2)SO42-的空间构型为 (用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,[Cu(OH)4]2-中的配位原子为 (填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为 ;推测抗坏血酸在水中的溶解性: (填“难溶于水”或“易溶于水”)。
(4)一个Cu2O晶胞(如图2)中,Cu原子的数目为 。
答案 (1)[Ar]3d9或1s22s22p63s23p63d9
(2)正四面体 O
(3)sp3、sp2 易溶于水 (4)4
[教师专用题组]
【5年高考】
考点一 化学键、电子式
1.(2020天津,12,3分)已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O ΔH
用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是 ( )
A.等物质的量的[Co(H2O)6]2+和[CoCl4]2-中σ键数之比为3∶2
B.由实验①可推知ΔH[CoCl4]2-
答案 D A项,1个[Co(H2O)6]2+中σ键数为6+2×6=18,1个[CoCl4]2-中σ键数为4,错误;B项,置于冰水浴中溶液变成粉红色,说明平衡逆向移动,也说明逆反应是放热反应,则正反应是吸热反应,ΔH>0,错误;C项,H2O是纯液体,平衡移动与c(H2O)没有关系,错误;D项,加少量ZnCl2固体,溶液变成粉红色,说明平衡[Co(H2O)6]2++4Cl-[CoCl4]2-+6H2O逆向移动,是因为Zn2+结合Cl-生成了更稳定的配离子[ZnCl4]2-,正确。
2.(2018浙江4月选考,19,2分)下列说法正确的是 ( )
A.CaCl2中既有离子键又有共价键,所以CaCl2属于离子化合物
B.H2O汽化成水蒸气、分解为H2和O2,都需要破坏共价键
C.C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点不同
D.水晶和干冰都是共价化合物,均属于原子晶体
答案 C CaCl2中只有离子键无共价键,故A错误;H2O汽化成水蒸气,只克服分子间作用力,不破坏共价键,故B错误;分子间作用力影响分子晶体的沸点,故C正确;水晶和干冰都是共价化合物,但水晶属于原子晶体,干冰属于分子晶体,故D错误。
3.(2020浙江7月选考,26,4分)(1)气态氢化物热稳定性HF大于HCl的主要原因是 。
(2)CaCN2是离子化合物,各原子均满足8电子稳定结构,CaCN2的电子式是 。
(3)常温下,在水中的溶解度乙醇大于氯乙烷,原因是 。
答案 (1)原子半径FCl—H
(2)Ca2+[N········C····N····]2-
(3)乙醇与水之间形成氢键而氯乙烷没有
解析 (1)F和Cl属于同主族元素,原子半径:FO>C (3)CH4或SiH4 (4)7
解析 A.(1)Fe是第26号元素,基态核外电子排布式为[Ar]3d64s2(或1s22s22p63s23p63d64s2);[Fe(H2O)6]2+中Fe2+提供空轨道,H2O分子中的O原子提供孤电子对,形成配位键。(2)NH3分子中,氮原子与三个氢原子形成三对共用电子对,氮原子还有一对孤电子对,所以N为sp3杂化;同周期元素第一电离能从左到右呈增大的趋势,氮原子的2p轨道为半满状态,具有稳定性,所以N的第一电离能比同周期相邻元素的大,第一电离能:N>O>C。(3)原子总数相同、价电子总数相同的分子或离子互为等电子体,NH4+的价电子总数为8,满足价电子总数为8的五核分子有CH4(或SiH4)。(4)1个该分子中有4个C—O键和3个CO键,则1mol柠檬酸分子中碳原子与氧原子形成的σ键共7mol。
5.(2019课标Ⅲ,35,15分)磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是 ,该元素基态原子核外M层电子的自旋状态 (填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的FeCl3的结构式为 ,其中Fe的配位数为 。
(3)苯胺()的晶体类型是 。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是 。
(4)NH4H2PO4中,电负性最高的元素是 ;P的 杂化轨道与O的2p轨道形成 键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
这类磷酸根离子的化学式可用通式表示为 (用n代表P原子数)。
答案 (1)Mg 相反
(2) 4
(3)分子晶体 苯胺分子之间存在氢键
(4)O sp3 σ
(5)(PnO3n+1)(n+2)-
解析 本题涉及知识点有对角线原则、核外电子排布、配位键、分子结构与性质等,通过能正确复述、再现、辨认相关基础知识,考查了接收、整合化学信息的能力,体现了宏观辨识与微观探析的学科核心素养。
(1)根据对角线原则,Li与Mg的化学性质最相似。基态时Mg原子的两个M层电子处于3s轨道上,且自旋方向相反。
(2)双聚FeCl3分子中两分子FeCl3以配位键形式结合在一起,结构式为,Fe的配位数为4。
(3)中只含有共价键,根据其熔、沸点数据可知,苯胺的晶体类型为分子晶体。苯胺分子间存在氢键,导致其熔、沸点高于甲苯。
(4)根据NH4H2PO4中所含元素在周期表中的位置关系和电负性规律可知,氧元素电负性最高。NH4H2PO4中磷原子的价层电子对数为4,故为sp3杂化,P的sp3杂化轨道与O的2p轨道形成σ键。
(5)磷酸根离子为PO43-,焦磷酸根离子为P2O74-,三磷酸根离子为P3O105-。结合图示可知,每增加1个P原子,O原子数增加3,离子所带负电荷数增加1,故可推出离子通式为(PnO3n+1)(n+2)-。
6.(2013课标Ⅰ,37,15分)硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 ,电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键
C—C
C—H
C—O
Si—Si
Si—H
Si—O
键能/(kJ·mol-1)
356
413
336
226
318
452
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,SiO44-四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。
答案 (1)M 9 4
(2)二氧化硅
(3)共价键 3
(4)Mg2Si+4NH4ClSiH4+4NH3+2MgCl2
(5)①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
②C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
(6)sp3 1∶3 [SiO3]n2n-(或SiO32-)
解析 (1)基态Si原子的电子排布式为1s22s22p63s23p2,电子占据的最高能层为第三层,符号为M,该能层原子轨道总数=1(3s轨道)+3(3p轨道)+5(3d轨道)=9,电子数为4。(3)6个面心位置贡献的Si原子数=6×12=3。(4)由题给信息可写出制备SiH4的化学方程式为Mg2Si+4NH4Cl2MgCl2+4NH3+SiH4。(5)可根据相关键能的数据解释相关的两个事实,详见答案。(6)在SiO44-四面体结构中,处于四面体中心的硅原子的杂化方式为sp3;单链结构的多硅酸根中,重复出现的最小结构单元为,其中Si原子数目为2,1、4号氧原子为两个单元所共有,2、3、5、6、7号氧原子完全属于该单元,故每个最小单元的氧原子数目为5+2×12=6,Si与O原子数之比为2∶6=1∶3,故单链结构的多硅酸根的化学式为[SiO3]n2n-。
思路分析 根据单质硅的结构和性质回答(1)、(2)、(3);由题目信息回答(4);通过比较碳和硅的有关化学键键能回答(5);分析题给图像来回答(6)。
7.(2013福建理综,31,13分)(1)依据第2周期元素第一电离能的变化规律,参照下图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
4NH3+3F2NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
[H3O]+
Q R
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键 b.共价键
c.配位键 d.金属键
e.氢键 f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚()具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸) Ka(苯酚)(填“>”或“
相关试卷
这是一份山东专用高考化学一轮复习专题八化学键分子结构与性质_模拟集训含解析,共45页。
这是一份2022版高考化学选考山东专用一轮总复习集训:专题三离子反应 —模拟,共36页。
这是一份2022版高考化学选考山东专用一轮总复习集训:专题十化学能与热能 —模拟,共40页。










