
2022版高考化学选考山东专用一轮总复习集训:专题九晶体结构与性质 —基础集训
展开
这是一份2022版高考化学选考山东专用一轮总复习集训:专题九晶体结构与性质 —基础集训,共11页。
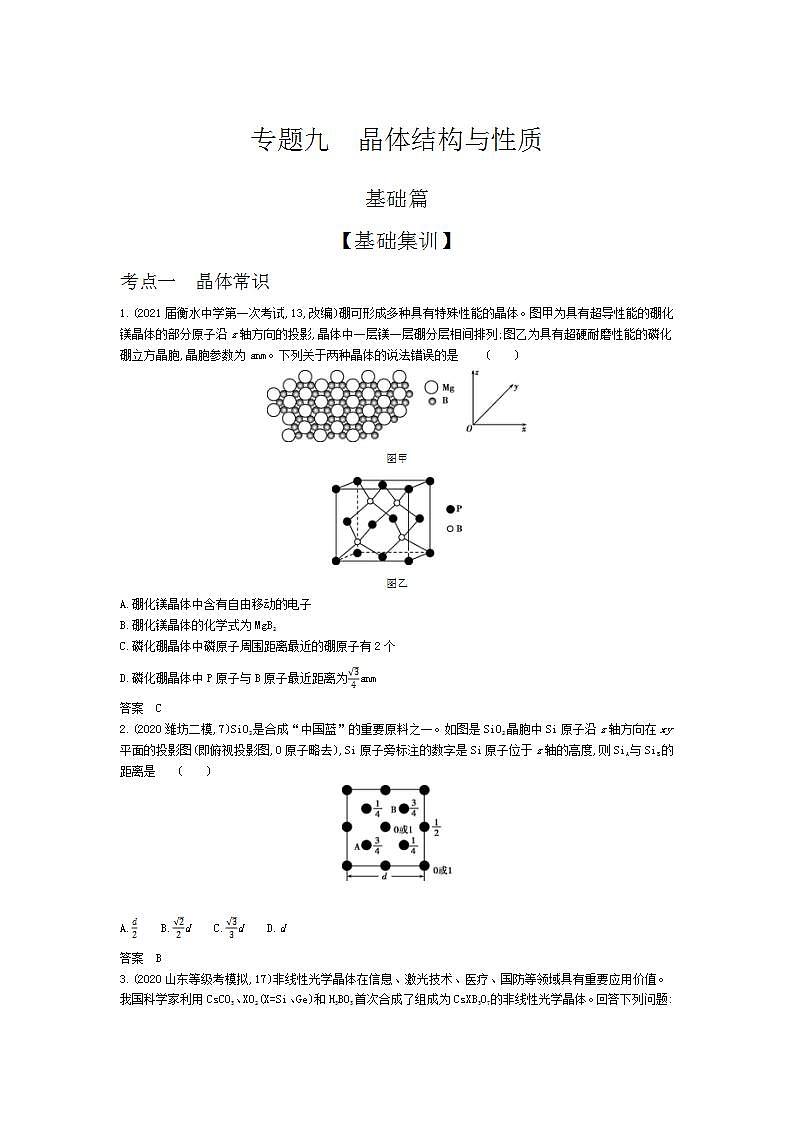
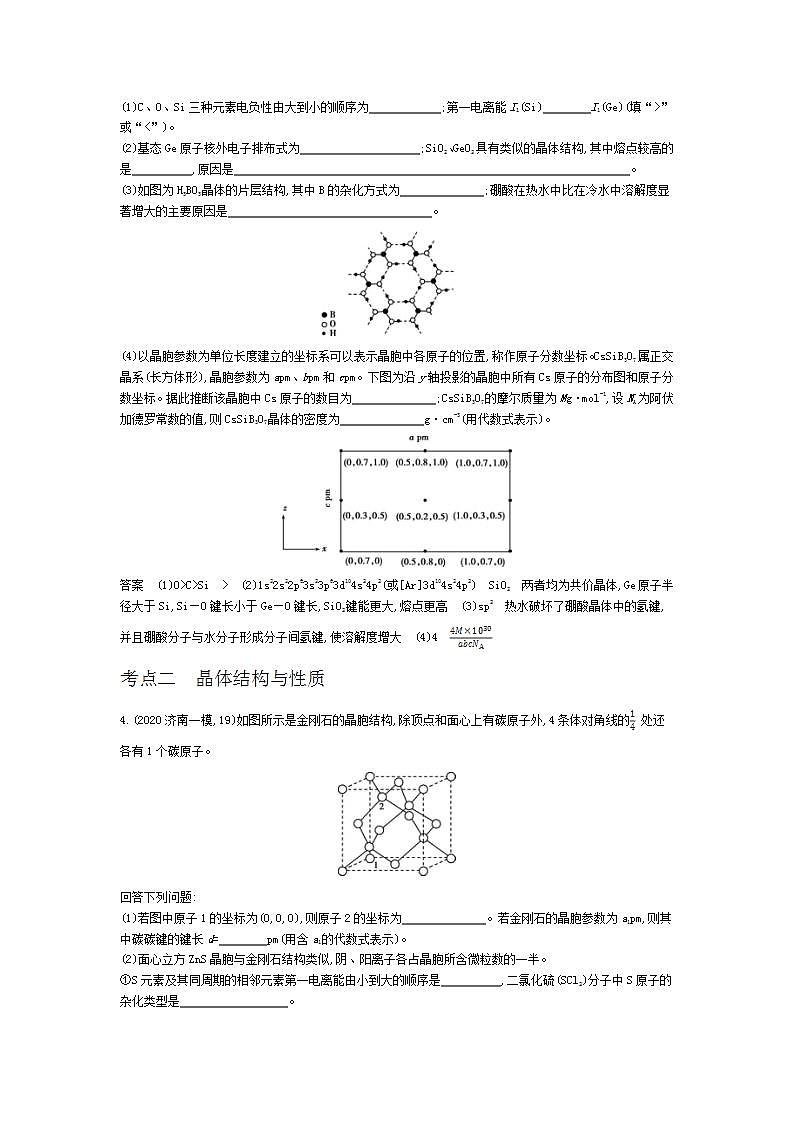
专题九 晶体结构与性质 基础篇【基础集训】考点一 晶体常识1.(2021届衡水中学第一次考试,13,改编)硼可形成多种具有特殊性能的晶体。图甲为具有超导性能的硼化镁晶体的部分原子沿z轴方向的投影,晶体中一层镁一层硼分层相间排列;图乙为具有超硬耐磨性能的磷化硼立方晶胞,晶胞参数为anm。下列关于两种晶体的说法错误的是 ( )图甲图乙A.硼化镁晶体中含有自由移动的电子B.硼化镁晶体的化学式为MgB2C.磷化硼晶体中磷原子周围距离最近的硼原子有2个D.磷化硼晶体中P原子与B原子最近距离为anm答案 C2.(2020潍坊二模,7)SiO2是合成“中国蓝”的重要原料之一。如图是SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图,O原子略去),Si原子旁标注的数字是Si原子位于z轴的高度,则SiA与SiB的距离是 ( ) A. B.d C.d D.d答案 B3.(2020山东等级考模拟,17)非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用CsCO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:(1)C、O、Si三种元素电负性由大到小的顺序为 ;第一电离能I1(Si) I1(Ge)(填“>”或“<”)。 (2)基态Ge原子核外电子排布式为 ;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是 ,原因是 。 (3)如图为H3BO3晶体的片层结构,其中B的杂化方式为 ;硼酸在热水中比在冷水中溶解度显著增大的主要原因是 。 (4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形),晶胞参数为apm、bpm和cpm。下图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为 ;CsSiB3O7的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为 g·cm-3(用代数式表示)。 答案 (1)O>C>Si > (2)1s22s22p63s23p63d104s24p2(或[Ar]3d104s24p2) SiO2 两者均为共价晶体,Ge原子半径大于Si,Si—O键长小于Ge—O键长,SiO2键能更大,熔点更高 (3)sp2 热水破坏了硼酸晶体中的氢键,并且硼酸分子与水分子形成分子间氢键,使溶解度增大 (4)4 考点二 晶体结构与性质4.(2020济南一模,19)如图所示是金刚石的晶胞结构,除顶点和面心上有碳原子外,4条体对角线的 处还各有1个碳原子。回答下列问题:(1)若图中原子1的坐标为(0,0,0),则原子2的坐标为 。若金刚石的晶胞参数为a1pm,则其中碳碳键的键长d= pm(用含a1的代数式表示)。 (2)面心立方ZnS晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。①S元素及其同周期的相邻元素第一电离能由小到大的顺序是 ,二氯化硫(SCl2)分子中S原子的杂化类型是 。 ②写出基态Zn2+的电子排布式: ;把晶胞示意图中表示Zn2+的小球全部涂黑。 ③锌锰干电池中Zn2+可吸收电池反应产生的NH3生成[Zn(NH3)4]2+,该离子中含有 个σ键。 ④若该ZnS晶胞的晶胞参数为a2pm,阿伏加德罗常数的值为NA,则晶体的密度为 g·cm-3(列出计算式)。 (3)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。有文献报道氨晶体中每个氢原子都形成氢键,则每个NH3与周围 个NH3通过氢键相结合。 答案 (1)(,,) (2)①S<P<Cl sp3 ②[Ar]3d10 或 ③16 ④ (3)65.(2020青岛二模,16)近期,我国科研人员在《Nature》发表了关于Pb(MN)O3-PbTiO3(PMN-PT)晶体性能及应用的研究论文。回答下列问题:(1)Pb位于元素周期表 区。 (2)下列状态的氧,电离最外层一个电子所需能量最高的是 (填标号)。 (3)阴、阳离子的电子云在对方离子电场作用下,发生形变。形变程度越大,稳定性越差。据此推测稳定性:MgCO3 BaCO3(填“>”“<”或“=”)。 (4)血红蛋白在血液中输送氧气,其结构如图1,Fe2+的配位数为 ,当空气中CO浓度较大时,人体会缺氧窒息,甚至死亡,其原理是 。 图1图2 (5)晶体α-X只含钠、镁、铅三种元素,其晶胞如图2,钠原子填满Pb原子的四面体空隙,X的化学式为 。若Pb原子与Na原子的最近距离为anm,则该晶胞的密度为 g·cm-3(用含a和NA的式子表示)。 答案 (1)p (2)b (3)< (4)6 CO与血红蛋白中的Fe2+的结合能力强于O2与Fe2+的结合能力,导致血红蛋白失去载氧能力 (5)Na2MgPb 6.(2020省实验中学模拟)铁氧体是一种磁性材料,具有广泛的应用。(1)铁元素位于元素周期表的 区,其基态原子有 种能量不同的电子。 (2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2]、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是 ,醋酸钠中碳原子的杂化类型是 。 (3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,N的结构式为 (标出配位键),铵盐大多不稳定,NH4F、NH4I中,较易分解的是 。 (4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。①晶胞中亚铁离子处于氧离子围成的 (填空间结构)空隙。 ②解释Fe3O4晶体能导电的原因 ;若晶胞的体对角线长为anm,则Fe3O4晶体的密度为 g·cm-3。(阿伏加德罗常数的值用NA表示) 答案 (1)d 7 (2)O>N>C>H sp3、sp2 (3)[]+ NH4F(4)①四面体 ②电子可在两种不同价态的铁离子间快速转移 综合篇【综合集训】1.(2020临沂一模,17)锂离子电池是指以锂离子嵌入化合物作正极材料的电池。研究锂离子电池的电极材料、电解液具有重要的现实意义。(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。①Li+能量最低的激发态的电子排布图为 。 ②第四电离能I4(Co)比I4(Fe)小,原因是 。 (2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯()用作该电解液的添加剂。①LiBF4中阴离子的空间构型为 。 ②碳酸亚乙酯分子中碳原子的杂化方式为 ;碳酸亚乙酯能溶于水的原因是 。 (3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:硫离子:(0,0,0);(,,0);(,0,);(0,,)……锂离子:(,,);(,,);(,,);(,,)……①在图中画出硫化锂晶胞沿x轴投影的俯视图。②与硫离子最近的Li+的个数为 。 ③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为 g·cm-3(列出计算表达式)。 答案 (1)①②Co3+失去3d6上的一个电子变成较稳定的3d5,而Fe3+从较稳定的3d5上失去一个电子变为不稳定的3d4,需要更多的能量(2)①正四面体 ②sp3、sp2 碳酸亚乙酯分子与水分子之间形成氢键(3)① ②8 ③2.(2020泰安三模,16)硝酸盐被广泛用作肥料和氧化剂。有学者最新研究发现氮在ZnFe0.4Co1.6O4上直接电化学氧化可生成硝酸盐。回答下列问题:(1)Fe、Co、Ni均位于元素周期表第 族,其中基态Ni原子的核外电子排布式为 ;Zn与Co的第一电离能I1(Zn) I1(Co)(填“<”或“>”)。 (2)图1是一种钴(Co)金属催化剂的结构,其中六元环上的N原子的杂化方式为 ;NH3、PH3中沸点更高的是 ,原因是 。 图1 图2 (3)一种由O、Na、Cl元素构成的良好的离子导体,具有反钙钛矿晶体结构(如图2),则其化学式为 ,设其晶胞边长为anm,NA为阿伏加德罗常数的值,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有 个,该晶胞的密度为 g·cm-3。 答案 (1)Ⅷ [Ar]3d84s2 >(2)sp2 NH3 NH3分子间能形成氢键(3)Na3OCl 3 ×10213.(2020聊城一模,17)钛及其化合物应用广泛。(1)钛元素基态原子核外最外层电子的自旋呈 状态(填“相同”或“相反”)。 (2)已知一定条件下TiO2与TiCl4之间可以相互转化:TiO2TiCl4。①Ti、Cl、O三种元素电负性由大到小的顺序为 。 ②COCl2的分子构型为 ,键角大小比较:∠Cl—C—O ∠Cl—C—Cl(填“>”或“<”),σ键和π键数目之比为 。 ③已知室温下TiCl4为无色易溶于乙醇的液体,则TiCl4的晶体类型为 。 (3)配合物[TiCl(H2O)3]Cl2·H2O中,中心离子的配位数是 ,向1mol 该配合物中加入足量AgNO3溶液,可以得到 molAgCl沉淀。 (4)金红石型TiO2的晶胞(α=β=γ=90°)如图所示,TiO2晶体中O原子周围Ti原子最多有 个,其晶胞参数为a=b=459pm、c=295pm,该晶体密度为 g/cm3(列出计算式)。 答案 (1)相反 (2)①O>Cl>Ti ②平面三角形 > 3∶1 ③分子晶体 (3)4 2 (4)3 4.(2020滨州三模)铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:(1)铜元素位于元素周期表中 区,基态Cu原子有 种不同能级的电子。 (2)铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如下反应实现铜离子的富集回收。①M所含元素的电负性由大到小的顺序为 (用元素符号表示)。 ②X中采用sp3杂化的非金属原子有 (填元素名称)。 (3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是 ,Y的沸点比水低的主要原因是 。 (4)向蓝色{[Cu(H2O)4}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3)4}。通过上述实验现象可知,与C的配位能力:H2O NH3(填“大于”或“小于”)。 (5)CuCl2和CuCl是铜的两种氯化物。①图中表示的是 (填“CuCl2”或“CuCl”)的晶胞。 ②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为 。 ③晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为 g·cm-3(列出计算式即可)。 答案 (1)ds 7(或七)(2)①O>N>C>H ②碳、氧(3)V形(或角形) 水分子间存在氢键,H2S分子间不存在氢键(4)小于(5)①CuCl ②(,,) ③5.(2020日照二模)氮、磷、砷、硫、氯等元素在生产生活和药物合成中用途广泛。回答下列问题:(1)瑞德西韦是一种抗病毒药物,结构如下。该结构中N、O、P原子的电负性由大到小的顺序为 。该药物的分子间作用力有 。 (2)(异环磷酰胺)常用作抗癌药,1mol 该物质分子含σ键数目为 NA。 (3)实验测得[Mn(SCN)6]4-中Mn、C、N三种原子不在同一水平线上。则此配合物中配位原子为 ,其杂化方式为 。 (4)Na3AsO4可用作杀虫剂,其中所含As元素基态原子的价电子排布式为 ,的空间构型为 。 (5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示,已知晶胞参数为acm,阿伏加德罗常数的值为NA,该晶胞中含有的P原子个数为 ,该晶体的密度为ρg·cm-3,晶体中白磷分子之间的最短距离为 cm(用含ρ、NA的式子表示)。 答案 (1)O>N>P 氢键、范德华力 (2)29 (3)S sp3 (4)4s24p3 正四面体 (5)16 ×6.(2020济南外国语学校月考)第Ⅷ族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。回答下列问题:(1)基态Ni原子核外能量最高的电子位于 能级,同周期元素中,基态原子未成对电子数与Ni相同的元素名称为 。 (2)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚()和对苯二酚()均显绿色。邻苯二酚的熔沸点比对苯二酚 (填“高”或“低”),原因是 。 (3)有历史记载的第一个配合物是Fe4[Fe(CN)6]3(普鲁士蓝),该配合物的内界为 。下表为Co2+、Ni2+不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,Ni2+比较稳定的配离子配位数是 (填“4”或“6”)。Co3+性质活泼,易被还原,但很稳定,可能的原因是 。 离子配位数晶体场稳定化能(Dq)Co2+6-8Dq+2P4-5.34Dq+2PNi2+6-12Dq+3P4-3.56Dq+3P(4)NiO晶体结构中阴、阳离子的配位数均为6,则晶胞的俯视图可能是 (填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为NA,晶体的密度是 g·cm-3。 答案 (1)3d 钛、锗、硒 (2)低 邻苯二酚形成分子内氢键,对苯二酚易形成的分子间氢键,故邻苯二酚熔沸点低 (3)[Fe(CN)6]4- 6 形成配位键后,三价钴的氧化性减弱,性质变得稳定(4)CD
相关试卷
这是一份2022版高考化学选考山东专用一轮总复习集训:专题四氧化还原反应 —基础集训,共7页。
这是一份2022版高考化学选考山东专用一轮总复习集训:专题十化学能与热能 —基础集训,共6页。
这是一份2022版高考化学选考山东专用一轮总复习集训:专题九晶体结构与性质 —模拟,共38页。









