



高考化学专题复习 专题十一 物质结构与性质_第3讲 晶体结构与性质课件PPT
展开
这是一份高考化学专题复习 专题十一 物质结构与性质_第3讲 晶体结构与性质课件PPT,文件包含第3讲晶体结构与性质pptx、第3讲晶体结构与性质docx等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
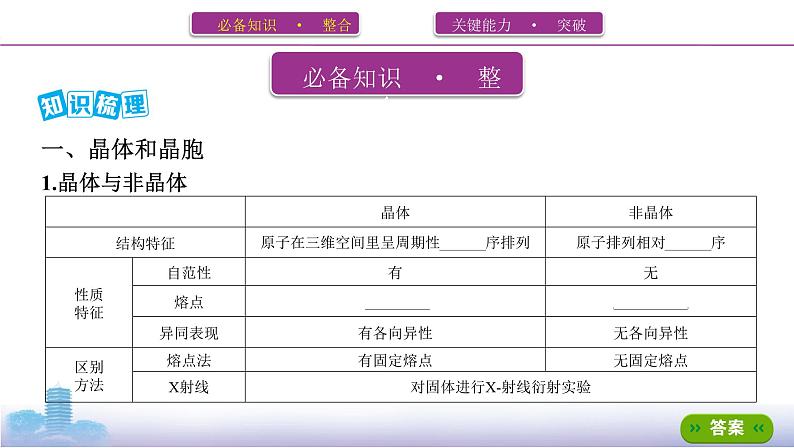
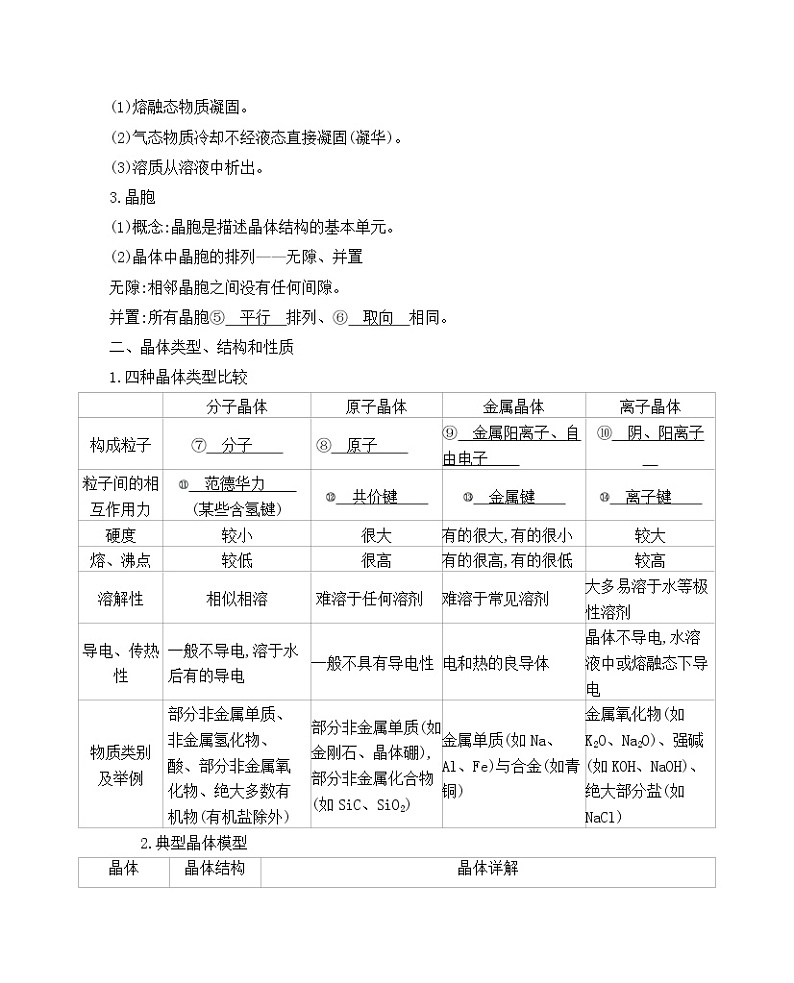
2.获得晶体的三条途径(1)熔融态物质凝固。(2)气态物质冷却不经液态直接凝固(凝华)。(3)溶质从溶液中析出。
3.晶胞(1)概念:晶胞是描述晶体结构的基本单元。(2)晶体中晶胞的排列——无隙、并置无隙:相邻晶胞之间没有任何间隙。并置:所有晶胞 平行 排列、 取向 相同。
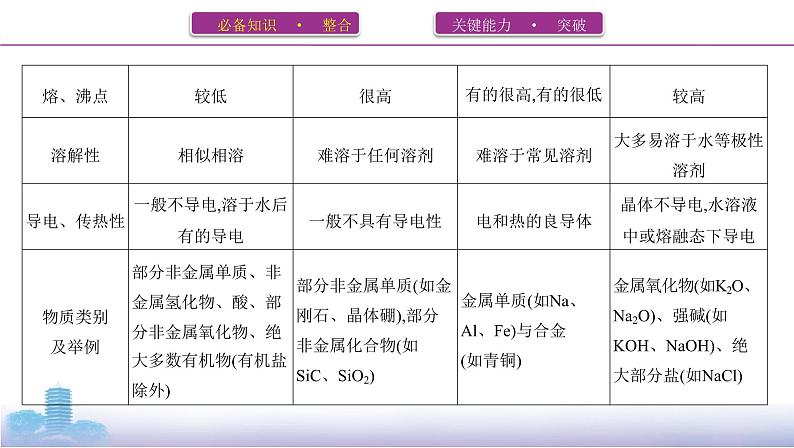
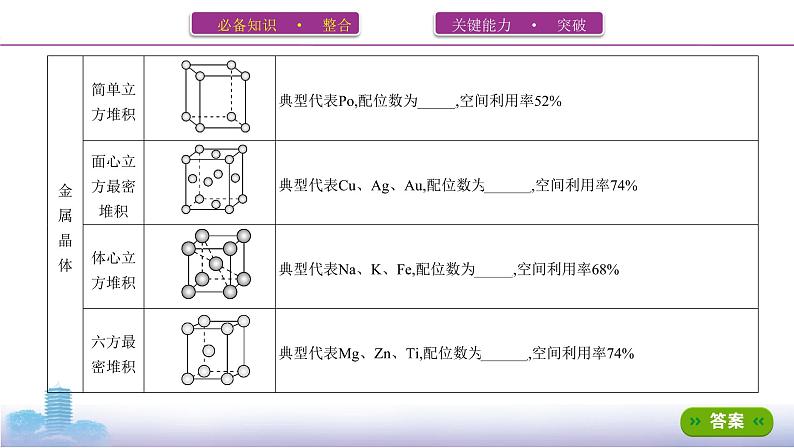
二、晶体类型、结构和性质
3.晶格能(1)定义气态离子形成1 ml离子晶体释放的能量,通常取正值,单位: kJ·ml-1 。(2)影响因素a.离子所带电荷数:离子所带电荷数越多,晶格能越 大 。b.离子的半径:离子的半径越 小 ,晶格能越大。(3)与离子晶体性质的关系晶格能越大,形成的离子晶体越 稳定 ,且熔点越 高 ,硬度越 大 。
三、晶胞组成的计算——“均摊法”
1.易错易混辨析(正确的画“√”,错误的画“✕”)。(1)在晶体中只要有阴离子就一定有阳离子 ( )(2)在晶体中只要有阳离子就一定有阴离子 ( )(3)原子晶体的熔点一定比金属晶体的高 ( )(4)分子晶体的熔点一定比金属晶体的低 ( )(5)离子晶体一定都含有金属元素 ( )
(6)金属元素和非金属元素组成的晶体不一定是离子晶体 ( )(7)金属钠形成的晶体中,每个钠原子周围与其距离最近的钠原子有8个 ( )(8)在CsCl晶体中,每个Cs+周围与其距离最近的Cl-有8个 ( )
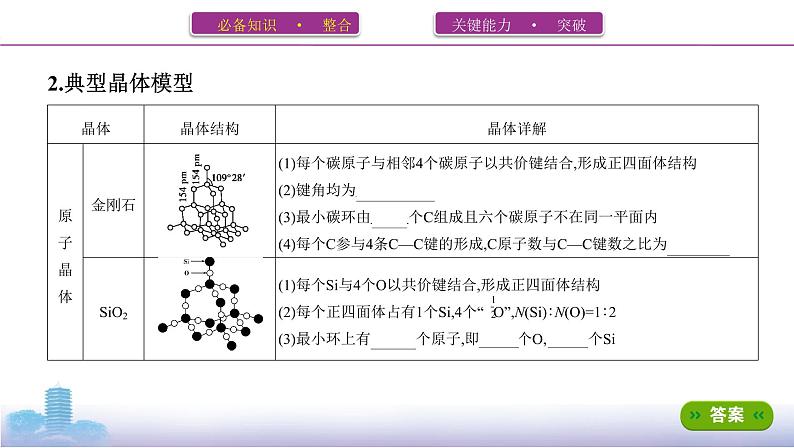
2.用“>”或“SiC>Si ,理由是 C—C键、C—Si键、Si—Si键的键长依次增大,键能依次减小,熔点依次降低 。(2)干冰、冰二者的熔点较高的是 冰 ,其理由是 冰晶体中分子间存在氢键 。(3)CS2熔、沸点高于CO2的理由是 CS2和CO2均为分子晶体,CS2的相对分子
质量大,分子间作用力大,因此CS2熔、沸点高于CO2 。(4)BN、MgBr2、SiCl4的熔点高低的顺序为 BN>MgBr2>SiCl4 。
题组三 晶体熔、沸点的比较
名师总结晶体熔、沸点高低的比较方法1.不同类型晶体熔、沸点的比较不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。2.同种类型晶体熔、沸点的比较(1)原子晶体 。(2)离子晶体a.一般来说,阴、阳离子所带的电荷数越多,离子半径越小,则离子间的作用力
越强,其晶体的熔、沸点越高。
b.晶格能越大,形成的离子晶体越稳定,熔点越高。(3)分子晶体a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高。b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。c.组成和结构不相似的分子晶体(相对分子质量接近),其分子的极性越大,
熔、沸点越高,如CO>N2。d.同分异构体,支链越多,熔、沸点越低。(4)金属晶体金属离子半径越小,离子所带电荷数越多,其金属键越强,金属晶体的熔、沸
点越高。
考点二 晶胞及其相关计算
题组一 “均摊法”在长方体晶胞计算中的应用
1.下列是几种常见的晶胞结构,填写晶胞中含有的粒子数。
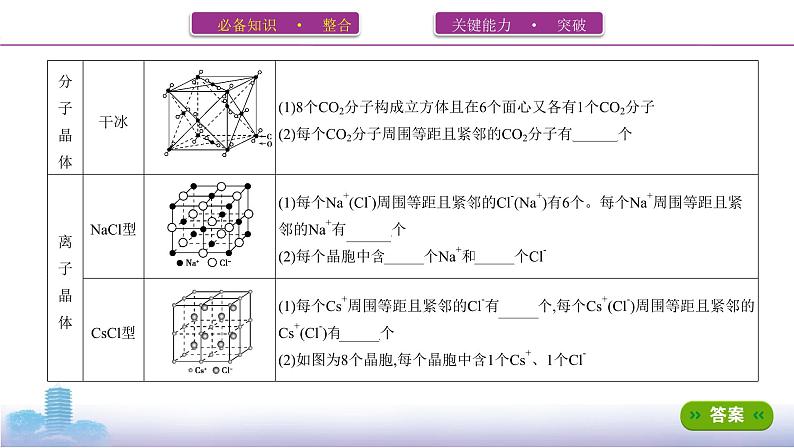
A.NaCl(含 4 个Na+, 4 个Cl-)B.干冰(含 4 个CO2)C.CaF2(含 4 个Ca2+, 8 个F-)D.金刚石(含 8 个C)E.体心立方(含 2 个原子)F.面心立方(含 4 个原子)
2.(1)Zn与S形成的化合物晶体的晶胞如图a所示。 图a①在1个晶胞中,Zn2+的数目为 4 。②该化合物的化学式为 ZnS 。
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图b为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 2 ,该功能陶瓷的化学式为 BN 。 图b
题组二 “均摊法”在非长方体晶胞计算中的应用
3.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是 ( )A.3∶9∶4B.1∶4∶2C.2∶9∶4D.3∶8∶4
4.石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结
合。据图分析,石墨晶体中碳原子数与共价键数之比为 ( )A.2∶3B.2∶1C.1∶3D.3∶2
题组三 利用晶胞进行相关物理量的计算
5.(1)碳的一种单质C60可以与钾形成低温超导化合物,晶体结构如图所示。K原子位于立方体的棱上和立方体的内部,此化合物的化学式为 K3C60 ;其晶胞参数为1.4 nm,设NA为阿伏加德罗常数的值,晶体密度为 2.0 g·cm-3(保留两位有效数字)。
(2)铝单质为面心立方晶体,其晶胞参数a=0.405 nm,设NA为阿伏加德罗常数的
值,晶胞中铝原子的配位数为 12 。列式表示铝单质的密度: g·cm-3(不必计算出结果)。(3)某离子晶体晶胞的结构如图所示。X( )位于立方体顶点,Y( )位于立方体中心。设该晶体的摩尔质量为M g·ml-1,晶体的密度为ρ g·cm-3,设NA为阿伏加
德罗常数的值,则晶体中两个距离最近的X之间的距离为 × cm。
(4)用晶体的X-射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜晶胞的体积是 4.70×10-23 cm3,晶胞的质量是 4.23×10-22 g,阿伏加德罗常数为 NA= ≈6.01×1023ml-1 [列式计算,已知Ar(Cu)=63.6]。
(5)B、E两种元素形成的某种化合物的晶胞结构如图(白色球代表B原子)。
已知B、E的原子半径分别为a pm、b pm。在该晶胞中,B原子的配位数为 6 。该晶胞的空间利用率φ为 ×100% 。
解析 (1)根据晶胞的结构,C60位于顶点和面心,个数为8× +6× =4,K位于棱上和内部,个数为12× +9=12,因此化学式为K3C60,晶胞的质量为 g,晶胞的体积为(1.4×10-7)3 cm3,根据密度的定义,计算可得晶胞的密度约为2.0 g·cm-3。(2)面心立方晶胞中,铝原子的配位数为12;晶胞中Al原子数为8× +6× =4,铝单质的密度ρ= = = g·cm-3。(3)由题意知,该晶胞中含有 个XY2或Y2X,设晶胞的边长为a cm,则有ρa3NA=
名师总结晶体结构的相关计算(1)空间利用率= ×100%。(2)金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a)a.面对角线长= a;b.体对角线长= a;c.体心立方堆积4r= a(r为原子半径);d.面心立方堆积4r= a(r为原子半径)。
1.(1)(2020课标Ⅱ)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、
传感器、固体电阻器等的功能材料,一种立方钙钛矿结构的金属卤化物光电
材料的组成为Pb2+、I-和有机碱离子CH3N ,其晶胞如图(b)所示。其中Pb2+与图(a)中 Ti4+ 的空间位置相同,有机碱CH3N 中,N原子的杂化轨道类型是 sp3 ;若晶胞参数为a nm,则晶体密度为 ×1021 g·cm-3(列出计算式)。
(2)(2020课标Ⅲ)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
氨硼烷晶体的密度ρ= g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(3)(2020天津)Fe、C、Ni是三种重要的金属元素。CO的面心立方晶胞如
图所示。设阿伏加德罗常数的值为NA,则CO晶体的密度为 g·cm-3;
三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为 NiO>
CO>FeO 。
一个晶胞中有 4 个Sn,找出距离Cd(0,0,0)最近的Sn (0.5,0,0.25)、(0.5,0. 5,0) (用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有 4 个。
解析 (1)距离Pb2+最近的是处于面心的I-,Pb2+的配位数为6,题图(a)中Ti4+的配
位数也为6,其与题图(b)中Pb2+的空间位置相同;CH3N 中,氮原子形成4个单键,其中有1个是配位键,N原子采取sp3杂化;根据均摊法,1个晶胞中含有I-的个
数为6× =3,CH3N 的个数为8× =1,Pb2+的个数为1,化学式为PbCH3NH3I3,摩尔质量为620 g·ml-1,一个晶胞的质量为 g,体积为(a×10-7)3 cm3,则晶体密度为 ×1021 g·cm-3。(2)根据氨硼烷的2×2×2超晶胞结构图可知,每个晶胞含有16个NH3BH3分子,
则1个晶胞的质量为 = g,1个晶胞的体积为2a×10-10×2b×10-10×
子,则底面Sn原子分数坐标为(0.5,0.5,0),侧面Sn原子分数坐标为(0.5,0,0.25);
底面Sn原子被两个晶胞共用,根据底面Sn原子分析可知,与单个Sn原子键合
的As原子个数为2×2=4。
2.(2019课标Ⅰ,35节选)(3)一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因 Li2O、MgO为离子晶体,P4O6、SO2为
分子晶体。晶格能MgO>Li2O。分子间力(分子量)P4O6>SO2 。(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的
四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得
的截图。可见,Cu原子之间最短距离x= a pm,Mg原子之间最短距离y=
a pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是 g·cm-3(列出计算表达式)。
3.(2019课标Ⅱ,35节选)一种四方结构的超导化合物的晶胞如图1所示。晶胞
中Sm和As原子的投影位置如图2所示。 图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,
4.(1)(2018课标Ⅰ)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为 g·cm-3(列出计算式)。
(2)(2018课标Ⅱ)FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为 ×1021 g·cm-3;晶胞中Fe2+位于 所形成的正八面体的体心,该正八面体的边长为 a nm。
(3)(2018课标Ⅲ)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为
六方最密堆积(A3型) 。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常
数的值为NA,Zn的密度为 g·cm-3(列出计算式)。
相关课件
这是一份人教版高考化学一轮复习第12章物质结构与性质第3讲晶体结构与性质课件
这是一份苏教版高考化学一轮复习12物质结构与性质第39讲晶体结构与性质课件,共60页。PPT课件主要包含了不固定,任何间隙,kJ·mol-1,金属阳离子,范德华力,正八面体,立方体,晶胞的计算,晶胞参数及相关计算等内容,欢迎下载使用。
这是一份2022高考化学一轮复习第11章物质结构与性质第3讲晶体结构与性质课件,共44页。PPT课件主要包含了知识点1,周期性有序,不固定,各向异性,各向同性,X射线衍射,基本单元,任何间隙,知识点2,分子间作用力等内容,欢迎下载使用。









