







所属成套资源:-2022学年人教版 (2019) 选择性必修一(课件+习题)
高中化学人教版 (2019)选择性必修1第四节 化学反应的调控课文课件ppt
展开这是一份高中化学人教版 (2019)选择性必修1第四节 化学反应的调控课文课件ppt,文件包含第四节化学反应的调控pptx、第四节化学反应的调控docx等2份课件配套教学资源,其中PPT共12页, 欢迎下载使用。
合成氨反应的特点 合成氨反应:N2(g)+3H2(g) 2NH3(g)。已知298 K时:ΔH=-92.4 kJ·ml-1,ΔS=-198.2 J·ml-1·K-1。(1)可逆性:反应为① 可逆 反应。
(2)体积变化:正反应是气体体积② 减小 的反应。(3)焓变:ΔH③ < 0,熵变ΔS④ < 0。(4)自发性:298 K时,ΔH-TΔS<0,能自发进行。
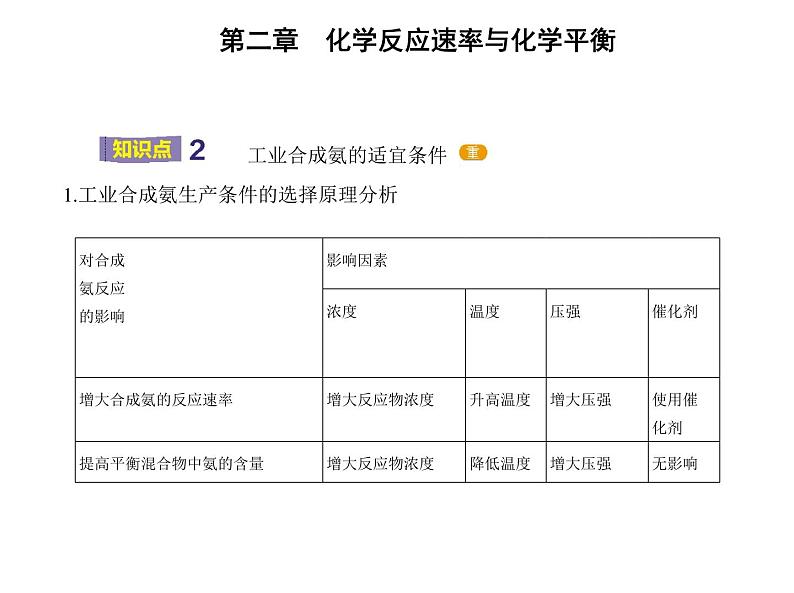
工业合成氨的适宜条件 1.工业合成氨生产条件的选择原理分析
2.实际生产条件的选择
化学反应的调控 1.影响化学反应进行的因素首先是参加反应的物质的组成、结构和性质等本身因素,其次是温度、压强、浓 度、催化剂等反应条件。2.化学反应的调控(1)含义:通过改变反应条件使一个可能发生的反应按照某一方向进行。(2)考虑实际因素:结合设备条件、安全操作、经济成本等情况,综合考虑影响化 学反应速率和化学平衡的因素,寻找适宜的生产条件;根据环境保护及社会效益 等方面的规定和要求做出分析,权衡利弊,才能实施生产。
判断正误,正确的画“√”,错误的画“✕”。1.从合成塔出来的混合气体中,NH3只占15%,所以氨的产率很低 ( ✕ )2.氨易液化,N2、H2在实际生产中可循环使用,所以总体来说合成氨的产率很高 ( √ )3.铁触媒作催化剂可加快反应速率,且有利于化学平衡向合成氨的方向移动 ( ✕ )4.在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),反应需在300 ℃下进行,可推测该反应是吸热反应 ( ✕ )提示:加热可以加快化学反应速率,在工业生产中,放热反应也可能需要在加热条 件下进行。
自1784年氨被发现以来,人们一直在研究如何利用化学方法由氮气和氢气合成 氨,但直到1913年才实现了合成氨的工业化生产。经过研究人员的不断努力,几 十年后终于有了日产氨1 000吨的大型装置。 合成氨工业生产流程示意图
工业上选择适宜生产条件的原则
问题1.合成氨工业生产中增大压强既可提高反应速率,又可提高氨的产量,那么在合成氨工业中压强是否越大越好?为什么?提示:不是。压强越大需要的动力越大,对材料的强度和设备的制造要求越高,目 前我国合成氨工厂一般采用的压强为10 MPa~30 MPa。2.既然降低温度有利于平衡向生成氨的方向移动,那么生产中是否温度越低越 好?为什么?提示:不是。温度过低反应速率太慢,需要很长时间才能达到平衡,很不经济,所以 实际生产中,采用500 ℃左右的适宜温度(在此温度时催化剂的活性最强)。3.在合成氨工业中要使用催化剂,既然催化剂对化学平衡的移动没有影响,为什么 还要使用?提示:为了加快反应速率,工业合成氨普遍使用以铁为主体的多成分催化剂。
外界条件对工业合成物质的反应的影响
CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH < (填“>”或 “<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是 在250 ℃、1.3×104 kPa下,CO的转化率已较大,再增大压强,CO的转化 率提高不大,而生产成本增加,可能造成经济效益降低 。
相关课件
这是一份人教版 (2019)选择性必修1第四节 化学反应的调控图文课件ppt,共29页。
这是一份高中化学人教版 (2019)选择性必修1第四节 化学反应的调控优秀课件ppt,共23页。PPT课件主要包含了学习目标,的动力越大,有利于生产的条件等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第四节 化学反应的调控图文课件ppt,共34页。PPT课件主要包含了目标素养,知识概览,自主预习,预习检测等内容,欢迎下载使用。













