

高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡同步测试题
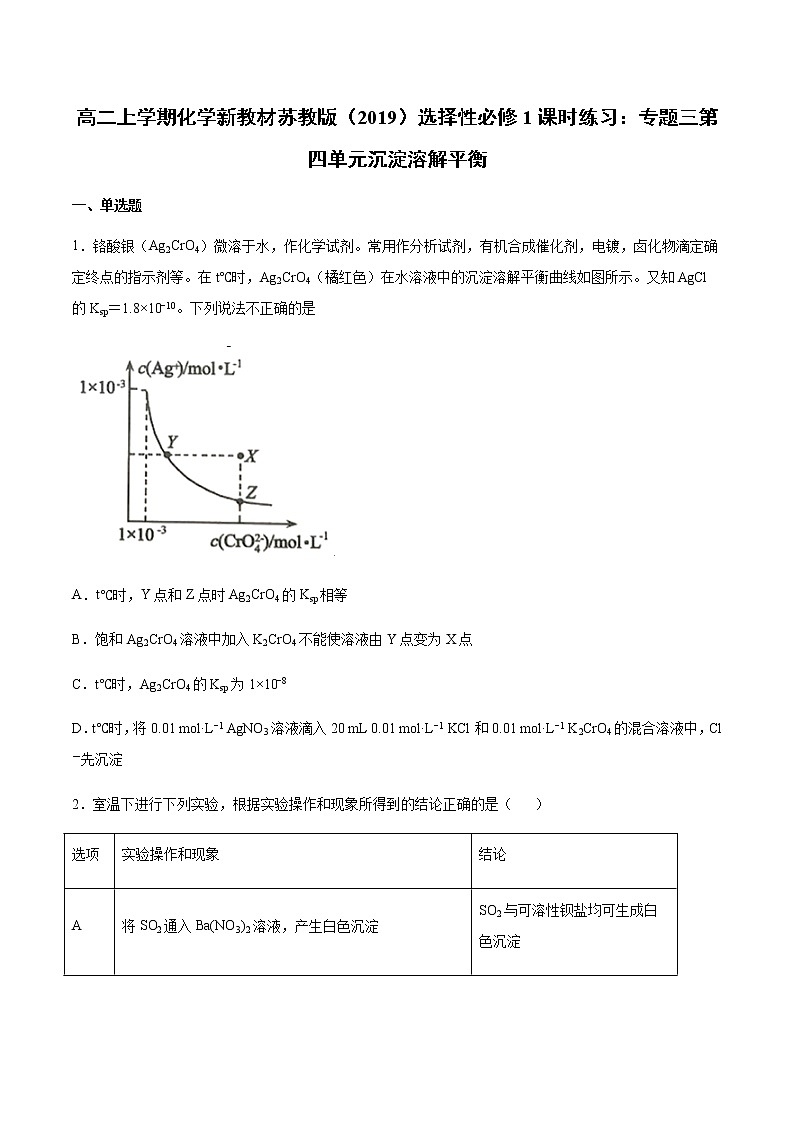
展开1.铬酸银(Ag2CrO4)微溶于水,作化学试剂。常用作分析试剂,有机合成催化剂,电镀,卤化物滴定确定终点的指示剂等。在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10−10。下列说法不正确的是
A.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Ag2CrO4的Ksp为1×10−8
D.t℃时,将0.01 ml·L−1 AgNO3溶液滴入20 mL 0.01 ml·L−1 KCl和0.01 ml·L−1 K2CrO4的混合溶液中,Cl-先沉淀
2.室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
A.AB.BC.CD.D
3.在一定温度下,Fe(OH)3固体在水溶液中存在如下平衡:Fe(OH)3(s)Fe3+(aq)+3OH-(aq),要使Fe(OH)3固体减少而c(Fe3+)不变,可采取的措施是( )
A.加少量水B.加入少量盐酸C.加入少量FeCl3D.升高温度
4.电镀废液中可通过下列反应转化成铬黄(PbCrO4):(aq)+2Pb2+(aq)+H2O(l)⇌2PbCrO4(s)+2H+(aq) ΔH<0。该反应达平衡后,改变条件,下列说法正确的是
A.移走部分PbCrO4固体,转化率升高 B.加入少量K2Cr2O7固体后,溶液中c(H+)不变
C.加入少量NaOH固体,自然沉降后,溶液颜色变浅 D.升高温度,该反应的平衡常数K增大
5.室温下,向20mL含有0.10ml/LCr2+和0.10ml/LFe2+的混合溶液中滴加0.10ml/LNaOH溶液,金属阳离子的浓度与滴入NaOH溶液体积的关系如图所示。若溶液中金属阳离子浓度小于10-5ml/L可视为完全沉淀,则下列说法错误的是( )
已知:Ksp[Cr(OH)2]=2.0×10-16ml3/L3,Ksp[Fe(OH)2]=8.0×10-16ml3/L3
A.曲线A表示c(Fe2+)与NaOH溶液体积的关系 B.当V(NaOH溶液)=30mL时,Cr2+开始沉淀
C.当pH=7时,溶液中Fe2+、Cr2+均完全沉淀 D.当V(NaOH溶液)>30mL时,溶液中c(Fe2+):c(Cr2+)=4
6.已知25℃时,AgCl的溶度积Ksp=1.8×10-10 ml2·L-2,则下列说法正确的是( )
A.向饱和AgCl水溶液中加入盐酸, Ksp变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl沉淀析出
D.在AgCl的悬浊液中加入Na2S溶液,AgCl转化为Ag2S,因为AgCl溶度积大于Ag2S
7.用来解释下列事实的方程式,不正确的是( )
A.向AgCl悬浊液中滴加Na2S溶液,沉淀由白色变为黑色:2AgCl+S2- =Ag2S+2Cl-
B.向碳酸氢铵溶液中加入足量氢氧化钠溶液:NH3H2O+OH-= +OH-
C.向Na2SiO3溶液中通入过量CO2制备硅酸凝胶
D.将氯气通入石灰乳中,制备漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
8.在BaSO4饱和溶液中加入少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后的溶液中( )
A.c(Ba2+)=c(SO)= B.c(Ba2+)•c(SO)>,c(Ba2+)=c(SO)
C.c(Ba2+)•c(SO)=,c(Ba2+)>c(SO) D.c(Ba2+)•c(SO)≠,c(Ba2+)
A.的水解常数为
B.溶于水形成的饱和溶液中,
C.向悬浊液中加入,溶液中增大
D.的平衡常数
10.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备的实验方案:
注:溶液中某种离子的浓度小于,可认为该离子不存在。
实验过程中,假设溶液体积不变。已知:,,,。
下列说法正确的是( )
A.沉淀X为
B.滤液M中存在,不存在
C.滤液N中存在和
D.步骤②中若改为加入固体,沉淀Y为和的混合物
11.常温时,,,,,下列叙述不正确的是( )
A.浓度均为的溶液和溶液等体积混合一定产生沉淀
B.将的溶液滴入浓度均为的和的混合溶液中,先产生沉淀
C.为的溶液要产生沉淀,溶液的pH应控制在8.5以上
D.在其他条件不变的情况下,向饱和溶液中加入溶液,不变
12.已知:。常温下,,的电离平衡常数、。常温下,向10mL的溶液中滴加Na2S溶液,滴加过程中pNi与溶液体积的关系如图所示。下列说法错误的是( )
A.E、F、G三点中,F点溶液中水的电离程度最小
B.常温下,
C.反应的平衡常数
D.溶液中,第一步水解常数
13.下列有关实验原理、方法和结论都正确的是
A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明还原产物是铜
B.取一定量水垢加盐酸,生成能使澄清石灰水变浑浊的气体,说明水垢的主要成分为CaCO3、MgCO3
C.向5 mL 0.1 ml·L-1KI溶液中加入0.1 ml·L-1的FeCl3溶液1 mL,振荡,用苯萃取2~3次后取下层溶液滴加5滴KSCN溶液,出现血红色,说明反应2Fe3++2I-=2Fe2++I2是有一定限度的
D.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)
A.pH相等的NaOH和Na2CO3溶液c(NaOH)<c(Na2CO3)。
B.将Mg、Al与NaOH溶液组成原电池,Al电极溶解,说明Al比Mg金属活动性强。
C.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用滴定管时水洗后还需润洗,但容量瓶水洗后不用润洗。
D.分别用等体积的蒸馏水和稀硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤时的损失量。
15.下述实验能达到预期实验目的的是
A.AB.BC.CD.D
二、解答题
16.ZrO2是重要的耐高温材料,可用作陶瓷遮光剂和良好的催化剂。天然锆英石(ZrSiO4含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如图:
已知:
①锆英石能与烧碱高温反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如表:
(1)锆英石碱熔时需要粉碎,其目的是___。
(2)ZrSiO4中Zr的化合价为___。滤渣2的主要成分为___。
(3)“碱熔”过程中ZrSiO4发生反应的化学方程式___。
(4)本流程使用NaCN除铜,若盐酸溶解后溶液中c(Cu2+)=0.01ml∙L-1,当溶液中Cu2+开始沉淀时,c(CN-)=___。(已知Ksp[Cu(CN)2]=4×10-10)
(5)向除Cu后所得滤液中加氨水调pH=b,发生的离子方程式为___。
(6)过滤时需要用到的玻璃仪器___。
(7)由氢氧化锆制备高纯二氧化锆的方法是___。
17.某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是___________________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式_______________________。
(2)“滤液②”中含有的金属离子是___________________________。
(3)“转化”中可替代H2O2的物质是_________________。若工艺流程改为先“调pH”后“转化”,即
“滤液③”中可能含有的杂质离子为________。
(4)如果“转化”后的溶液中Ni2+浓度为1.0 ml·L-1,则“调pH”应控制的pH范围是_____________________。
(5)硫酸镍在强碱溶液中用NaC1O氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式____________________________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是_________________________。
18.某含镍(NiO)废料有FeO、Al2O3、 MgO、SiO2等杂质,用此提取NiSO4的工艺流程如图所示:
已知:①金属离子生成氢氧化物沉淀所需的pH如图所示。
②25℃时,HF 电离常数Ka=7.2×10-4, Ksp(MgF2)=7. 4X10-11
(1)"酸浸”时,为提高漫出速率,可采取的措施有_________(写一条即可)。
(2)废渣1的主要成分是_______(填化学式)。“氧化”步骤中加入H2O2的目的是________(用离子方程式表示)。加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是_________(填化学式)。
(3)25℃时,1 ml/L的NaF溶液中c(OH- )=_______(列出计算式即可) ml/L.
(4)已知沉淀前溶液中c(Mg2+)= 1.85×10-3ml/L,当除镁率达到99%时,溶液中c(F- )=______ml/L.
选项
实验操作和现象
结论
A
将SO2通入Ba(NO3)2溶液,产生白色沉淀
SO2与可溶性钡盐均可生成白色沉淀
B
向AgNO3溶液中逐滴加入浓度均为0.05ml·L-1的NaI、NaCl混合溶液,有黄色沉淀生成
Ksp(AgCl)>Ksp(AgI)
C
向FeCl3溶液中加入Cu粉,Cu粉溶解
Cu的还原性大于Fe
D
向盛有H2O2溶液的试管中滴几滴酸化的FeCl2溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现
铁离子催化H2O2的分解
模拟海水中的离子浓度/()
0.439
0.050
0.011
0.560
0.001
序号
实验内容
实验目的
A
从AlCl3溶液提取无水AlCl3
将AlCl3溶液灼烧蒸干
B
向盛有0.1ml/L1mL硝酸银溶液的试管中滴加0.1ml/LNaCl溶液,至不再有沉淀生成,再向其中滴加0.1ml/LNa2S溶液
说明一种沉淀能转化为另一种溶解度更小的沉淀
C
将含有HCl杂质的CO2气体通入到氢氧化钠溶液中
除去CO2气体中的HCl杂质
D
配制澄清的FeCl3浓溶液
将FeCl3固体置入少量水中搅拌
离子
Fe3+
Al3+
ZrO2+
开始沉淀时pH
1.9
3.3
6.2
完全沉淀时pH
3.2
5.2
8.0
金属离子
开始沉淀时()的pH
7.2
3.7
2.2
7.5
完全沉淀时()的pH
8.7
4.7
3.2
9.0
参考答案
1.C2.D3.A4.C5.C6.D7.B8.C9.B10.A11.B12.D13.C14.B15.B
16.增大接触面积,加快反应速率 +4 Al(OH)3和Fe(OH)3 ZrSiO4+4NaOHNa2ZrO3+Na2SiO3+2H2O 2×10−4ml∙L-1 ZrO2++2NH3∙H2O+H2O=Zr(OH)4↓+2 漏斗、烧杯、玻璃棒 高温焙烧
17.除去油脂,溶解铝及其氧化物 +H+=Al(OH)3↓+H2O Ni2+、Fe2+、Fe3+ O2或空气 Fe3+ 3.2~6.2 2Ni2++ClO-+4OH-=2NiOOH↓+Cl-+H2O 提高镍回收率
18.增加硫酸浓度或提高反应温度(合理即可) SiO2 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3、Al(OH)3 2.0×10-3
化学选择性必修1第四单元 沉淀溶解平衡练习: 这是一份化学选择性必修1第四单元 沉淀溶解平衡练习,共12页。试卷主要包含了取1 mL 0,已知Ksp=1,已知等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 溶液的酸碱性同步训练题: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 溶液的酸碱性同步训练题,共9页。试卷主要包含了单选题,解答题等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡综合训练题: 这是一份苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡综合训练题,共9页。试卷主要包含了单选题,解答题等内容,欢迎下载使用。













