








所属成套资源:备战高考 2022年高三化学二轮复习专题精品课件PPT+练习
- 专题六 氧化还原反应与电化学课件PPT 课件 0 次下载
- 专题七 化学反应与热能课件PPT 课件 0 次下载
- 专题十 化学实验课件PPT 课件 0 次下载
- 专题九 水溶液中的离子平衡课件PPT 课件 1 次下载
- 专题十一 常见有机物及其应用课件PPT 课件 0 次下载
专题八 化学反应速率与化学平衡课件PPT
展开
这是一份专题八 化学反应速率与化学平衡课件PPT,文件包含专题八化学反应速率与化学平衡pptx、专题突破练八化学反应速率与化学平衡docx等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
高考总复习
GAO KAO ZONG FU XI
第一编
2022
内容索引
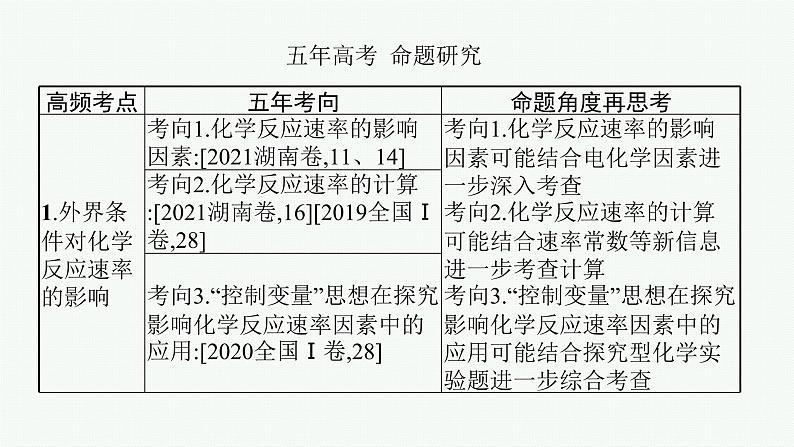
考点一 外界条件对化学反应速率的影响
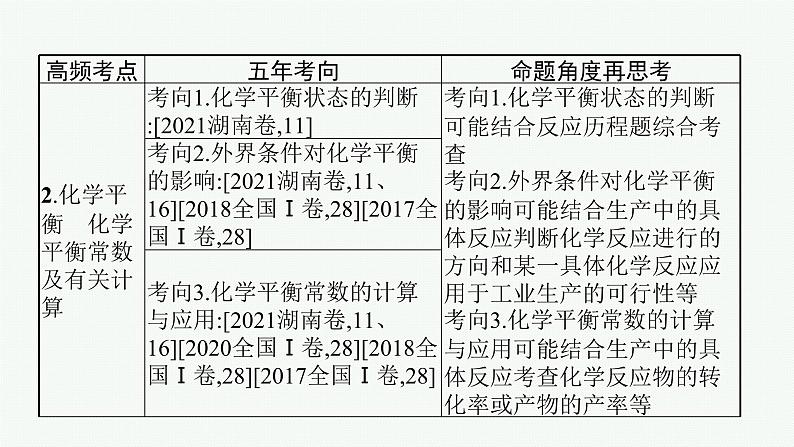
考点二 化学平衡 化学平衡常数及有关计算
考点三 化学反应速率与化学平衡的有关图像
专项模块 素养培优
五年高考 命题研究
考点一 外界条件对化学反应 速率的影响
要点归纳•再提升
一、化学反应速率的计算及速率常数1.化学反应速率的计算
计算时一定要注意容器或溶液的体积,不能忽视容器或溶液的体积V,盲目地把Δn当作Δc代入公式进行计算,同时还要注意单位及规范书写,还要根据要求注意计算值的处理。
2.速率常数(1)假设基元反应(能够一步完成的反应)为aA(g)+bB(g)==cC(g)+dD(g),其速率可表示为v=k·ca(A)·cb(B),式中的k称为反应速率常数或速率常数,它表示单位浓度下的化学反应速率,与浓度无关,但受温度、催化剂、固体表面性质等因素的影响,通常反应速率常数越大,反应进行得越快。不同反应有不同的速率常数。
(2)正、逆反应的速率常数与平衡常数的关系
二、正确理解化学反应速率的影响因素
1.内因——活化能相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同所致,活化能小的化学反应速率快,活化能大的化学反应速率慢。注意:反应热为正、逆反应活化能的差值。
影响反应速率的主要因素
2.外因相同的化学反应,在不同条件下,化学反应速率不同,主要原因是外因——浓度、压强、温度、催化剂、光照、接触面积等因素。(1)浓度(c):增大(减小)反应物浓度→单位体积内活化分子数目增加(减少),活化分子百分数不变→有效碰撞频率提高(降低)→化学反应速率加快(减慢)。(2)压强(p):对于气相反应来说,增大(减小)压强→相当于减小(增大)容器容积→相当于增大(减小)反应物的浓度→化学反应速率加快(减慢)。
化学反应确定后,只能通过改变外因改变反应速率
微点拨“ 惰性气体”对反应速率的影响
(3)温度(T):升高(降低)温度→活化分子百分数增大(减小)→有效碰撞频率提高(降低)→化学反应速率加快(减慢)。(4)催化剂①添加催化剂能改变反应的路径,降低反应的活化能,所以化学反应速率加快。②催化剂的选择性:对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂还具有大幅度提高目标产物在最终产物中比例的作用。③酶作催化剂的特点:高效性、专一性(高选择性,一种酶只能催化一种或一类化学反应,如蛋白酶只能催化蛋白质水解成多肽)、温和性(反应条件温和,温度升高,酶发生变性失去催化活性)。
经典对练•得高分
考向1 化学反应速率的影响因素真题示例1-1.(2021福建新高考适应卷,5)有研究认为,强碱性溶液中反应I-+ClO-==IO-+Cl-分三步进行,其中两步如下:第一步 ClO-+H2O→HOCl+OH- K1=3.3×10-10第三步 HOI+OH-→IO-+H2O K3=2.3×103下列说法错误的是( )A.反应第二步为HOCl+I-→HOI+Cl-B.由K可判断反应第三步比第一步快C.升高温度可以加快ClO-的水解D.HOCl和HOI都是弱酸
思路点拨
答案 B
1-2.(2021湖北新高考适应卷,18节选)甲烷和水蒸气催化制氢主要有如下两个反应:①CH4(g)+H2O(g) ==CO(g)+3H2(g)ΔH=+206 kJ·mol-1②CO(g)+H2O(g) ==CO2(g)+H2(g)ΔH=-41 kJ·mol-1恒定压强为100 kPa时,将n(CH4)∶n(H2O)=1∶3的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
回答下列问题:(1)写出CH4与CO2生成H2和CO的热化学方程式: 。 (2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是 (填标号)。 A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快D.加入合适的催化剂,降低反应温度也能实现单位时间内转化率不变
答案 (1)CH4(g)+CO2(g) ==2CO(g)+2H2(g) ΔH=+247 kJ·mol-1 (2)C
解析 (1)①CH4(g)+H2O(g) ==CO(g)+3H2(g) ΔH=+206 kJ·mol-1②CO(g)+H2O(g) ==CO2(g)+H2(g) ΔH=-41 kJ·mol-1根据盖斯定律,①-②,ΔH=+206 kJ·mol-1+41 kJ·mol-1=+247 kJ·mol-1,得到CH4与CO2生成H2和CO的热化学方程式:CH4(g)+CO2(g) ==2CO(g)+2H2(g)ΔH=+247 kJ·mol-1;
(2)由反应CH4(g)+H2O(g) ==CO(g)+3H2(g) ΔH=+206 kJ·mol-1,恒温、恒容条件下,加入惰性气体,总压强增大,各物质的分压不变,各气体的浓度不变,化学反应速率不变,故A不符合题意;恒温、恒容条件下,加入水蒸气,活化分子百分数不变,单位体积活化分子数增加,有效碰撞几率增大,反应速率加快,故B不符合题意;升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快,故C符合题意;加入合适的催化剂,缩短达到平衡的时间,但不影响平衡的移动,单位时间内气体的转化率改变;降低反应温度,平衡发生移动,单位时间内气体的转化率改变,故D不符合题意;答案选C。
对点演练
1-1.(2021河北石家庄模拟)为了研究碳酸钙粉末与稀盐酸反应的反应速率,某同学利用图1所示装置通过实验测定反应中生成的CO2的体积随反应时间变化的情况,绘制出图2所示的曲线。已知该反应是放热反应,下列说法正确的是( )
A.t1~t2段反应速率大于O~t1段的主要原因是此阶段盐酸的浓度较大B.t2~t3段反应速率小于t1~t2段的主要原因是此阶段反应体系的温度降低C.t4时刻不再产生气体,表明碳酸钙已经完全消耗D.微热锥形瓶时活塞向右移动,停止加热后活塞恢复至原位置,则装置气密性良好
答案 D
解析 t1~t2段反应速率大于O~t1段的主要原因是反应放热造成此阶段反应体系温度较高,A项错误;t2~t3段反应速率小于t1~t2段的主要原因是此阶段盐酸的浓度减小,B项错误;t4时刻不再生成气体,可能是盐酸反应完全,碳酸钙因过量而仍有剩余,C项错误;微热锥形瓶时活塞向右移动,停止加热后活塞恢复至原位置,表明装置气密性良好,D项正确。
1-2.资料显示:自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01 mol·L-1可以记做0.01M)。
下列说法不正确的是( )A.实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率D.若用1 mL 0.2 M的H2C2O4溶液做实验①,推测比实验①褪色快
答案 C 解析 根据化合价的变化可知,H2C2O4是还原剂,KMnO4是氧化剂,对比实验①和②可知,MnSO4对反应起催化作用,所以产物MnSO4能起自催化作用,故A、B项正确;实验③加入了稀盐酸之后,Cl-能与KMnO4发生氧化还原反应,所以褪色比①快,Cl-是还原剂而不是催化剂,故C错误;由于浓度会影响反应速率,所以增大H2C2O4溶液的浓度可以加快反应速率,故D正确。
考向2 化学反应速率的计算真题示例
计算曲线a的反应在30~90 min内的平均速率 (a)= kPa·min-1。
思路点拨根据定义式计算反应速率
答案 0.004 7
2-2.(2021河北卷,13)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N==X+Y;②M+N==X+Z。反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是( )
A.0~30 min时间段内,Y的平均反应速率为6.67×10-3 mol·L-1·min-1B.反应开始后,体系中Y和Z的浓度之比保持不变C.如果反应能进行到底,反应结束时62.5%的M转化为ZD.反应①的活化能比反应②的活化能大
答案 A
解析 考查化学反应速率的计算、转化率的计算、化学反应速率与活化能的关系等。反应①和②为竞争反应,由速率方程式可知,两个反应差异在速率常数的大小。图中显示,0~30 min内Δc(Z)=0.125 mol·L-1,Δc(M)=0.5 mol·L-1-0.3 mol·L-1=0.2 mol·L-1,Δc2(M)=Δc(Z)=0.125 mol·L-1,Δc(Y)=Δc1(M)=0.2 mol·L-1-0.125 mol·L-1=0.075 mol·L-1,v(Y)=0.075 mol·L-1÷30 min=0.002 5 mol·L-1·min-1,A项错误;由速率方程可知,
对点演练
2-1.(双选)(2021江西宜春模拟,改编)反应4A(s)+3B(g) 2C(g)+D(g)经过2 min,B的浓度减少0.6 mol·L-1。下列有关说法正确的有( )A.在2 min末时,反应物B的反应速率是0.3 mol·L-1·min-1B.在这2 min内用C表示的平均反应速率为0.2 mol·L-1·min-1C.在2 min时,B、C、D的浓度比一定为3∶2∶1D.若D的起始浓度为0.1 mol·L-1,则2 min时D的浓度为0.3 mol·L-1
答案 BD
解析 2 min末的反应速率为瞬时速率,2 min内用B表示的速率为0.3 mol·L-1·min-1,该速率是平均反应速率,A错误;根据化学反应速率之比等于化学计量数之比,在这2 min内用C表示的平均速率为B的平均速率的 ,即0.2 mol·L-1·min-1,B正确;因为起始浓度未知,因此在2 min时,B、C、D的浓度之比不一定为3∶2∶1,C错误;根据浓度的变化量之比等于化学计量数之比,2 min内D的浓度应增加0.2 mol·L-1,若D的起始浓度为0.1 mol·L-1,则2 min时D的浓度为0.3 mol·L-1,D正确。
2-2.(2021浙江卷)取50 mL过氧化氢水溶液,在少量I-存在下分解:2H2O2==2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2的浓度(c)如下表:
下列说法不正确的是( )A.反应20 min时,测得O2体积为224 mL(标准状况)B.20~40 min,消耗H2O2的平均速率为0.010 mol·L-1·min-1C.第30 min时的瞬时速率小于第50 min时的瞬时速率D.H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解
答案 C
解析 反应20 min时,过氧化氢的浓度变为0.4 mol·L-1,说明分解的过氧化氢的物质的量n(H2O2)=(0.80-0.40) mol·L-1×0.05 L=0.02 mol,过氧化氢分解生成的氧气的物质的量n(O2)=0.01 mol,标准状况下的体积V=n·Vm=0.01 mol×22.4 L·mol-1=0.224 L=224 mL,A项正确;20~40 min,消耗过氧化氢的浓度为(0.40-0.20) mol·L-1=0.20 mol·L-1,则这段时间内的平均速率
=0.010 mol·L-1·min-1,B项正确;随着反应的不断进行,过氧化氢的浓度不断减小,某一时刻分解的过氧化氢的量也不断减小,故第30 min时的瞬时速率大于第50 min时的瞬时速率,C项错误;I-在反应中起到催化的作用,故也可以利用过氧化氢分解酶或Fe2O3代替,D项正确。
考向3 “控制变量”思想在探究影响化学反应速率因素中的应用真题示例3.(双选)(2021河北新高考适应卷,15)一定条件下,反应H2(g)+Br2(g) ==2HBr(g)的速率方程为v=kcα(H2)cβ(Br2)cγ(HBr),某温度下,该反应在不同浓度下的反应速率如下:
根据表中的测定结果,下列结论错误的是( )A.表中c的值为4B.α、β、γ的值分别为1、2、-1C.反应体系的三种物质中,Br2(g)的浓度对反应速率影响最大D.在反应体系中保持其他物质浓度不变,增大HBr(g)浓度,会使反应速率降低
思路点拨
答案 AB
对点演练3-1.(2021河北石家庄二十七中月考)碘在科研与生活中有重要应用。某兴趣小组用0.20 mol·L-1 KI溶液、0.2%淀粉溶液、0.20 mol·L-1 (NH4)2S2O8溶液、0.10 mol·L-1 Na2S2O3溶液等试剂,探究反应条件对化学反应速率的影响。
结合表中数据判断下列说法错误的是( )A.a=5,b=5
答案 B
3-2.(2021浙江宁波模拟)已知酸性KMnO4溶液与H2C2O4溶液发生如下反应:2KMnO4+5H2C2O4+3H2SO4==2MnSO4+K2SO4+10CO2↑+8H2O。探究该反应反应速率的影响因素,有关实验数据如表所示。下列说法不正确的是( )
A.用KMnO4表示该反应的速率,v(实验3)约为2×10-3 mol·L-1·min-1B.表中数据a5C.实验1、2探究温度对反应的影响,实验3、4探究催化剂对反应的影响D.可通过比较收集相同体积的CO2所消耗的时间来判断反应速率快慢
答案 A
解析 实验3中,根据关系式2KMnO4~5H2C2O4可知,高锰酸钾的量不足,消耗高锰酸钾的物质的量为4×10-3 L×0.01 mol·L-1=4×10-5 mol,则用KMnO4表示实验3的反应速率为 ≈6.7×10-4 mol·L-1·min-1,A错误;温度越高反应速率越快,催化剂可加快反应速率,则a5,B正确;根据单一变量原则,实验1、2探究温度对反应速率的影响,实验3、4探究催化剂对反应速率的影响,C正确;比较收集相同体积CO2所消耗的时间,可判断反应速率的大小,进而可判断反应的快慢,D正确。
易错防范•不失分
判断正误(正确的画“√”,错误的画“×”)。(1)对于任何化学反应来说,反应速率越大,反应现象就越明显。( )(2)化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1。( )(3)由v= 计算平均速率,用反应物表示时为正值,用生成物表示时为负值。( )(4)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同。( )
(5)对于反应:2H2O2==2H2O+O2↑,加入MnO2或降低温度都能加快O2的生成速率。( )(6)由于固体浓度为一常数,所以块状CaCO3与粉末状CaCO3与等浓度的盐酸反应速率一样快。( )(7)100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变。( )(8)FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同。( )
答案 (1)× (2)× (3)× (4)√ (5)× (6)× (7)× (8)×
考点二 化学平衡 化学平衡 常数及有关计算
要点归纳•再提升
1.化学平衡状态的标志(1)绝对标志
(2)相对标志①有气体参加的反应,气体的总压强、总体积、总物质的量不变时,如果是等体积反应时,不一定达到平衡;如果是不等体积反应时,一定达到平衡。
不变时,要具体分析各表达式中的分子或分母的变化情况,判断是否平衡。③如果反应体系中的物质有颜色,则反应体系的颜色不变时,一定达到平衡。
2.“惰性气体(对反应无关的气体)”对化学平衡的影响(1)恒温恒容时:充入惰性气体,体系的总压强增大,但各反应成分的浓度不变,即各反应气体的分压不变,平衡不移动。(2)恒温恒压时:充入惰性气体,容器容积增大,各反应气体的浓度降低,相当于减压,化学平衡向着气体体积增大的方向移动。
实质是压强的改变导致气体的浓度改变
3.分析化学平衡移动的一般思路
4.化学平衡计算的基本模式——“三段式”根据反应进行(或平衡移动)的方向,设出某反应物消耗的量,然后列式求解。例如: mA + nB pC + qD起始量: a b 0 0变化量: mx nx px qx平衡量 : a-mx b-nx px qx其中:①各物质的变化量之比等于化学方程式中各物质的化学计量数之比。②这里a、b可指物质的量、浓度、气体体积等。
注意:(1)弄清起始量、平衡量、平衡转化率三者之间的互换关系。反应起始时,反应物和生成物可能同时存在。(2)由于起始浓度是人为控制的,故不同的物质起始浓度比不一定等于化学计量数之比。若反应物起始浓度之比等于化学计量数之比,则隐含着各反应物转化率相等,且平衡时各反应物的浓度之比等于化学计量数之比。(3)起始浓度之比、平衡浓度之比不一定等于化学计量数之比,但物质之间是按化学计量数之比反应和生成的,故各物质的浓度变化之比一定等于化学计量数之比,这是计算的关键。在计算平衡常数时,要注意反应物或生成物的状态。
经典对练•得高分
考向1 化学平衡状态的判断真题示例1.(2020浙江卷,29节选)研究NOx之间的转化具有重要意义。已知:N2O4(g) 2NO2(g) ΔH>0将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。下列可以作为反应达到平衡的判据是 。 A.气体的压强不变 B.v正(N2O4)=2v逆(NO2)C.K不变 D.容器内气体的密度不变E.容器内颜色不变
思路点拨
答案 AE
对点演练1-1.(2021广东佛山质检节选)向体积为1 L的恒容密闭容器中充入1 mol CH4和2 mol H2S,发生如下反应:CH4(g)+2H2S(g) CS2(g)+4H2(g),测得不同温度下,CH4的平衡转化率与温度的关系如图所示:
(1)1 200 ℃时,该反应的平衡常数K= (列出计算式即可); (2)下列情况能说明反应达到平衡状态的是 (填字母)。 A.4v(CH4)=v(H2)B.混合气体的压强保持不变C.混合气体的平均摩尔质量保持不变D.n(CH4)∶n(H2S)∶n(CS2)∶n(H2)=1∶2∶1∶4
解析 (1)由图可知,1 200 ℃时甲烷的平衡转化率为80%,平衡时甲烷的浓度为(1 mol·L-1-1 mol·L-1×80%)=0.2 mol·L-1,由方程式可知,硫化氢的浓度为(2 mol·L-1-0.8 mol·L-1×2)=0.4 mol·L-1、二硫化碳的浓度为0.8 mol·L-1、氢气的浓度为0.8 mol·L-1×4=3.2 mol·L-1,则化学平衡常数
(2)A.4v(CH4)=v(H2)不能说明正、逆反应速率相等,无法判断反应是否达到平衡状态,故错误;B.该反应是气体体积增大的反应,恒容密闭容器,随反应进行,混合气体的压强增大,则混合气体的压强保持不变说明正、逆反应速率相等,反应达到平衡状态,故正确;C.由质量守恒定律可知,反应前后气体的质量不变,该反应是气体物质的量增大的反应,反应中混合气体的平均摩尔质量减小,则混合气体的平均摩尔质量保持不变说明正、逆反应速率相等,反应达到平衡状态,故正确;D.n(CH4)∶n(H2S)∶n(CS2)∶n(H2)=1∶2∶1∶4不能说明正、逆反应速率相等,无法判断反应是否达到平衡状态,故错误。
1-2.(2021福建龙岩一模节选)利用CO2可合成烷烃、烯烃、醇等一系列重要化工原料。回答下列有关问题:制备甲烷:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH=-252.9 kJ·mol-1
该反应的ΔG(ΔG=ΔH-TΔS)与温度的关系如图所示。
(1)要使该反应能顺利发生,理论上温度不高于 。 (2)在恒温、恒容容器中进行该反应,下列不能说明反应达到平衡状态的是 。 A.CO2和H2的转化率之比不再变化B.混合气体的平均摩尔质量不再变化C.容器内的压强不再变化D.v正(H2)=4v正(CH4)
答案 (1)597 ℃ (2)AD
解析 (1)ΔG(ΔG=ΔH-TΔS)T1B.达到平衡时,T1温度对应反应放出的热量为m kJC.平衡时,通入氩气平衡正向移动D.平衡常数KaKA;②由于生成物n(H2)∶n(S2)=2∶1,所以曲线n对应的是H2的物质的量,曲线m对应的是H2S的物质的量,
2H2S(g) S2(g)+2H2(g) 8 4 8
③加入2.0 mol H2S的容器与加入1.0 mol H2S的容器相比,相当于加压,平衡逆移,即转化率减小,所以甲对应1.0 mol H2S分解的曲线;M、N两点容器内H2S的转化率相同,平衡时N点气体物质的量为M点的2倍,但N点温度较高,所以2p(M)0,m+n>p+q](1)速率曲线图
(2)转化率曲线图
2.几种特殊的图像(1)对于化学反应mA(g)+nB(g) pC(g)+qD(g),如下图甲、乙,M点之前,表示从反应物开始,v正>v逆;M点达到平衡;M点之后为平衡受温度的影响情况,即升温时A的百分含量增加、C的百分含量减少,平衡左移,故正反应的ΔHv逆;则l曲线的右下方(F点)v正”“T2,试说明理由: 。 Ⅱ.用催化剂Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯的过程中,还会生成CH4、C3H6、C4H8等副产物,若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性(选择性指的是转化的CO2中生成C2H4的百分比)。在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表:
(4)欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是 。
答案 (1)吸热 N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
(3)①> ②不能,因为温度不同,催化剂的活性不同,对反应速率造成的影响不同(4)K 助剂K降低了生成乙烯的反应所需要的活化能,加快乙烯的生成速率而对其他副反应的速率几乎无影响
(3)①T2温度下将2 mol N2和6 mol H2通入容积为1 L的密闭容器中,反应达到平衡时,根据“三段式”分析: N2(g)+3H2(g) 2NH3(g)起始/(mol·L-1) 2.0 6.0 0转化/(mol·L-1) 1.0 3.0 2.0平衡/(mol·L-1) 1.0 3.0 2.0
随着反应的进行,容器内压强降低,若某时刻容器内气体的压强为起始时的80%,说明反应未达到平衡,则反应正向进行,即v正>v逆。②虽然反应时使用同一催化剂,都是将2.0 mol N2和6.0 mol H2通入容积为1 L的密闭容器中,但分别在T1和T2温度下进行反应。不能根据图示信息判断温度的相对高低,因为温度不同,催化剂的活性不同,对反应速率造成的影响不同。(4)由表中数据可知,Na作助剂时其他副反应占比大,Cu作助剂时CO2转化率低,兼顾乙烯的产率、CO2转化率和对副反应的影响,选择添加K作助剂效果最好。加入助剂能提高单位时间内乙烯产量的根本原因是助剂K降低了生成乙烯的反应所需要的活化能,加快乙烯的生成速率而对其他副反应的速率几乎无影响。
本 课 结 束
相关课件
这是一份2024届高三化学二轮复习 专题八 化学反应速率和化学平衡 课件,共60页。PPT课件主要包含了答案C,答案B,答案D,答案BC,答案AB,考情分析,答案A等内容,欢迎下载使用。
这是一份专题5 反应热 化学反应速率与化学平衡课件PPT,共60页。PPT课件主要包含了2解题步骤等内容,欢迎下载使用。
这是一份2023版创新设计高考化学(新教材苏教版)总复习一轮课件专题八 化学反应速率与化学平衡,文件包含2023版创新设计高考化学新教材苏教版总复习一轮课件第一单元化学反应速率pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第三单元化学平衡的移动pptx、2023版创新设计高考化学新教材苏教版总复习一轮课件第二单元化学反应的方向与限度pptx等3份课件配套教学资源,其中PPT共180页, 欢迎下载使用。








