

广东省东莞市2021-2022学年高二上学期段考化学(选考)试题(word版含答案)
展开
这是一份广东省东莞市2021-2022学年高二上学期段考化学(选考)试题(word版含答案),共14页。试卷主要包含了单选题,填空题,实验题,原理综合题等内容,欢迎下载使用。
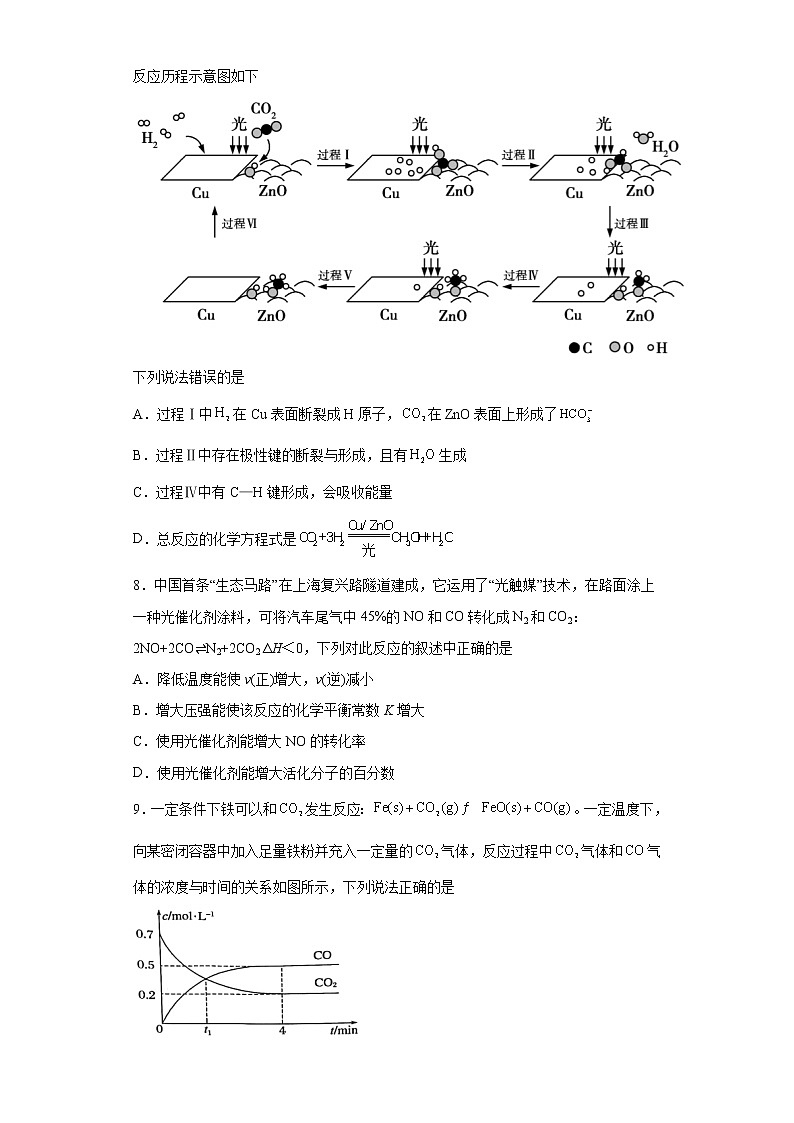
广东省东莞市2021-2022学年高二上学期段考化学(选考)试题学校:___________姓名:___________班级:___________考号:___________ 一、单选题1.化学与社会、生产、生活密切相关,下列说法不正确的是A.化学反应在物质变化的同时,伴随着能量变化,其表现形式有吸热和放热等B.食品放入冰箱中,因为温度低,变质速率降低,所以食品能够保存较长时间C.可以用勒夏特列原理解释夏天打开啤酒盖,喷出大量泡沫的现象D.将煤气化,有利于提供更多的能量,而且有效地减少温室气体的产生2.下列反应的热效应变化符合如下图所示的是A.光合作用B.乙醇燃烧C.铁粉与稀硫酸反应D.NaOH溶液与盐酸反应3.化学能与热能、电能等能相互转化,关于化学能与其他能量相互转化的说法错误的是A.化学反应中能量变化的主要原因是化学键的断裂与生成B.铝热反应中,反应物的总能量比生成物的总能量低C.图I所示的装置不能将化学能转变为电能D.图II所示的反应为放热反应4.生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,在大气中寿命可达740年之久。键能是指破坏(或生成)1mol化学键所需要吸收(或放出)的能量。结合表中信息,下列说法正确的是化学键N≡NF-FN-F键能(kJ/mol)941.7154.8283.0 A.过程N2(g)→2N(g)放出能量B.反应N2(g)+3F2(g) = 2NF3(g)是吸热反应C.稳定性:F-F键<N-F键D.NF3吸收能量后,肯定发生化学反应5.2SO2(g)+O2(g)⇌2SO3(g)反应过程中的能量变化如图。下列有关叙述不正确的是A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数B.将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应放热akJ,其热化学方程式为2SO2(g)+O2(g)⇌2SO3(g) ΔH=-2a kJ·mol-lC.该反应中,反应物的总键能小于生成物的总键能D.ΔH=-(E2-E1),使用催化剂改变活化能,但不改变反应热6.有关化学反应速率的说法,下列正确的是A.反应2A(g)+B(g)=3C(g)+4D(s),若反应速率v(A)=0.1 mol/(L·s),则也可用产物D表示为v(D)=12mol/(L·min)B.锌和足量稀硫酸制备H2的反应中,加入少量铜粉,产生H2的速率加快,H2的总量不变C.有气体参加的反应增大压强,活化分子百分数增加,反应速率加快,化学平衡发生移动D.对于可逆反应,升高温度,正逆反应速率均会增大,化学平衡常数变大7.科研人员利用Cu/ZnO作催化剂,在光照条件下实现了和合成,该反应历程示意图如下下列说法错误的是A.过程Ⅰ中在Cu表面断裂成H原子,在ZnO表面上形成了B.过程Ⅱ中存在极性键的断裂与形成,且有生成C.过程Ⅳ中有C—H键形成,会吸收能量D.总反应的化学方程式是8.中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2:2NO+2CO⇌N2+2CO2 ΔH<0,下列对此反应的叙述中正确的是A.降低温度能使v(正)增大,v(逆)减小B.增大压强能使该反应的化学平衡常数K增大C.使用光催化剂能增大NO的转化率D.使用光催化剂能增大活化分子的百分数9.一定条件下铁可以和发生反应:。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的气体,反应过程中气体和气体的浓度与时间的关系如图所示,下列说法正确的是A.时,正、逆反应速率的大小关系为B.的平均反应速率C.内,的转化率为71.4%D.保持体积不变,充入能减慢其反应速率10.下列图示与对应的叙述相符的是
A.图1表示C与O2反应的能量变化B.图2表示H2SO4溶液中滴入Ba(OH)2溶液,导电性随加入Ba(OH)2物质的量的变化C.图3表示其他条件一定,反应2SO2+O22SO3在有、无催化剂下SO2的体积分数随时间变化D.图4表示反应H2+I22HI达平衡后,升高温度时反应速率随时间的变化11.工业上可采用CH3OHCO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。下图为计算机模拟的各步反应的能量变化示意图,下列说法正确的是A.CH3OH脱氢反应的第一步历程为CH3OH* =CH3*+OH*B.该历程中最大活化能E正=157.2 kJ·mol-1C.该历程中,放热最多的步骤的化学方程式为CHO*+ 4H* =CO*+2H2(g)D.CH3OH* = CO*+2H2(g) △H= + 65.7 kJ•mol-112.向一密闭容器中充入和,压强为,并在一定温度下发生反应: ,一段时间后反应达到平衡。下列说法不正确的是A.保持容器容积不变,继续向其中加入1mol H2(g),反应正向进行B.保持容器容积不变,继续向其中加入1mol N2(g),化学反应速率不变C.保持容器压强不变,继续向其中加入2mol HI(g),重新达平衡时,HI的体积分数变大D.使用催化剂,正逆反应速率同时加快,平衡不移动13.工业上制取的反应之一为。一定压强下,向10 L密闭容器中充入和发生上述反应,和的消耗速率与温度的关系如图所示。下列说法正确的是
A.该反应的B.A点对应的状态为化学平衡状态C.使用高效催化剂能提高的平衡产率D.若300℃达平衡时,的转化率为α,则300℃时,该反应的化学平衡常数14.已知,在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率()与体系总压强(p)的关系如图所示。下列说法正确的是A.容器内气体的平均相对分子质量不变,说明反应达到化学平衡状态B.该反应正反应是吸热反应C.反应温度升高,A的转化率增大D.平衡状态由a变到b时,平衡正向移动,化学平衡常数K增大15.乙烯气相直接水合反应制备乙醇:。乙烯的平衡转化率随温度、压强的变化关系如下[起始时,,容器体积为1L]下列分析不正确的是
A.该反应是放热反应B.图中压强的大小关系为C.图中a点对应气体的平均摩尔质量:a=bD.达到平衡状态a、b所需要的时间:b>a16.下列有关可逆反应2A(g)+B(g)⇌2C(g) △H<0的图像正确的是A. B.C. D.17.对于平衡体系mA(g)+nB(g) pC(g)+qD(g) ΔH<0.下列结论中不正确的是A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的1.5倍,则m+n>p+qB.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的要小C.若平衡时,A、B 的转化率相等,说明反应开始时,A、B的物质的量之比为m∶nD.若m+n>p+q,则往含有a mol气体的平衡体系中再加入a mol 的B,达到新平衡时,气体的总物质的量小于2a mol18.对可逆反应2A(s)+3B(g)⇌C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v正减小③压强增大一倍,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆⑤加入催化剂,平衡向正反应方向移动⑥若反应与外界无热交换,当体系压强不变时可以作为平衡的标志A.①③ B.③④ C.④⑥ D.②⑤ 二、填空题19.请根据所学知识回答下列问题:(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2, ΔH1_______ΔH2(填“>”“<”或“=”,下同)。(2)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_______ΔH2。①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1 ②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2(3)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_______57.3 kJ。(4)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t ℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式_______。20.工业废气中CO的处理和合理利用,越来越受到关注。(1)在两个固定容积为2L的恒容密闭容器中均充入2molCO和2molNO,在不同条件下发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),测得反应体系的压强与时间t的变化曲线如图。①与实验a相比,实验b采取的措施可能是_______;②0~10min内,实验b对应条件下v(NO)=_______;③实验a条件下,反应的平衡常数Kc=_______。(2)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) △H。已知:υ(正)=k(正)·x(CO)·x2(H2),υ(逆)=k(逆)·x(CH3OH),其中x为各组分的体积分数。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。①p1_______ p2(填“>”“<”);升高温度,_______(“增大”“减小”或“不变”);②c、d、e三点平衡常数Kc、Kd、Ke三者之间的关系为_______③f点,=_______(保留三位有效数字)。(3)在一绝热恒容容器中,H2和CO按等物质的量混合反应,以下能说明反应达到平衡的是_______。A.容器内的总压强不再变化时 B.CO的体积分数保持不变时候C.容器内气体平均密度不变时 D.容器内气体温度恒定不变时 三、实验题21.探究化学反应的快慢和限度具有十分重要的意义。Ⅰ.某实验小组欲通过用酸性KMnO4和H2C2O4(草酸)反应测定单位时间内生成CO2的速率研究影响反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:实验序号A溶液B溶液①20mL0.1mol·L-1H2C2O4溶液30mL0.01mol·L-1KMnO4溶液②20mL0.2mol·L-1H2C2O4溶液30mL0.01mol·L-1KMnO4溶液 (1)上述反应的离子方程式为:___,该实验探究的是___对化学反应速率的影响。(2)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO)=____mol·L-1(假设混合溶液的体积为50mL,反应前后体积变化忽略不计)。(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定____来比较化学反应速率。(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:___。Ⅱ.K2Cr2O7溶液中存在平衡:Cr2O(橙色)+H2O2CrO(黄色)+2H+。用K2Cr2O7溶液进行下列实验:(5)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈____色,若再加入过量稀硫酸,则溶液呈____色。(6)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着____方向移动,溶液颜色变化为___。对比实验②和④可得出的结论是___。 四、原理综合题22.对N、S元素进行研究,可以保护环境,减少污染,又有利于工业生产的发展。(1)①可在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应经历如下两步:反应Ⅰ: ;反应Ⅱ: 。则由NO生成1mol的_______kJ/mol。②若反应Ⅰ比反应Ⅱ的反应速率大,下列能正确表示反2NO(g)+CO(g)N2O(g)+CO(g)的∆H在有催化剂(a)和无催化剂(b)时反应过程能量变化的图是_______(选填字母)。A. B. C. D. (2)相同温度下,两个体积均为1L的恒容密闭容器中,起始压强为p0,发生反应,各物质的物质的量如下表:容器编号起始时物质的量/mol平衡时物质的量/molNOCON2CO2CO2Ⅰ0.20.200a①容器Ⅰ中平衡后气体的压强为开始时的7/8,则a=_______。②容器Ⅰ平衡时的分压平衡常数Kp=_______。(用气体的平衡分压代替平衡浓度计算:某气体的分压=气体总压强×该气体的体积分数)(3)下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入3 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器分别发生反应2SO2(g)+O2(g)⇌2SO3(g)。已知起始时容器A和B的体积均为aL。①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为_______。②若条件不变打开K,一段时间后重新达到平衡,容器B的体积为_______L(连通管中气体体积忽略不计,且不考虑温度的影响)。
参考答案1.D2.A3.B4.C5.B6.B7.C8.D9.C10.B11.D12.C13.D14.A15.D16.A17.B18.C19.(1)=(2)<(3)>(4)CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+2a kJ·mol-120.(1) 使用催化剂 0.05mol·L-1·min-1 1 (2) > 减小 Kc>Kd=Ke 1.79 (3)AD21.(1) 2MnO+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 浓度 (2)0.0052(3)KMnO4溶液完全褪色所需时间(或产生相同体积气体所需时间)(4)反应放热或产物Mn2+是反应的催化剂(5) 黄 橙 (6) 正反应 橙色逐渐变浅,最后变为无色 K2Cr2O7酸性溶液氧化性强 22.(1) -352.8 D (2) 0.1 2/p0 (3) 40% 2a
相关试卷
这是一份广东省江门市第一中学2023-2024学年高二上学期11月第二次段考化学(选考)试题含答案,共13页。试卷主要包含了如右图所示,曲线a表示放热反应,一定条件下,将,下列说法中正确的是等内容,欢迎下载使用。
这是一份(Word版)广东省东莞市2022-2023学年高二上学期期末教学质量检查化学试题(Word版含答案),共16页。试卷主要包含了本试卷分第Ⅰ卷和第Ⅱ卷两部分, 化学让生活更美好, 下列物品中含有大量纤维素的是等内容,欢迎下载使用。
这是一份2020福建省泰宁一中高二上学期第一阶段考试化学(选考)试题含答案









