

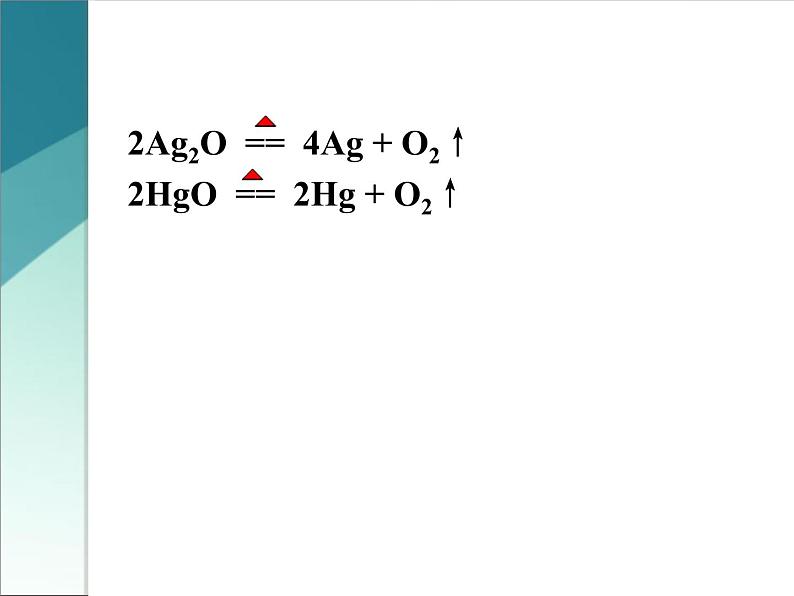



还剩35页未读,
继续阅读
人教版 (新课标)选修2 化学与技术课题2 金属材料授课ppt课件
展开
这是一份人教版 (新课标)选修2 化学与技术课题2 金属材料授课ppt课件,共43页。PPT课件主要包含了从矿石中获得金属,电解法,热分解法,钢铁的冶炼,1铁的冶炼,二金属腐蚀及防止,1化学腐蚀,金属腐蚀,原理原电池反应,Fe-2eFe2+等内容,欢迎下载使用。
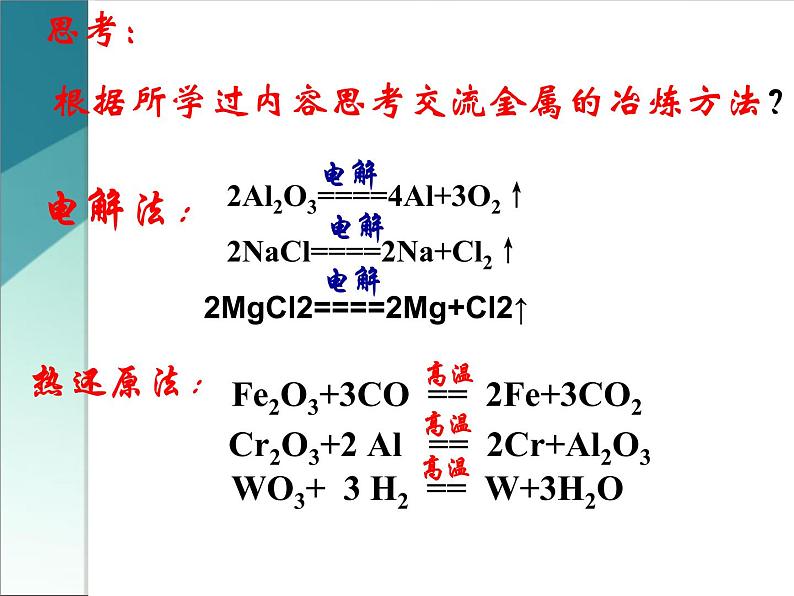
思考:根据所学过内容思考交流金属的冶炼方法?
不同金属冶炼方法的选择
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag
工序:探矿、采矿、选矿、冶炼
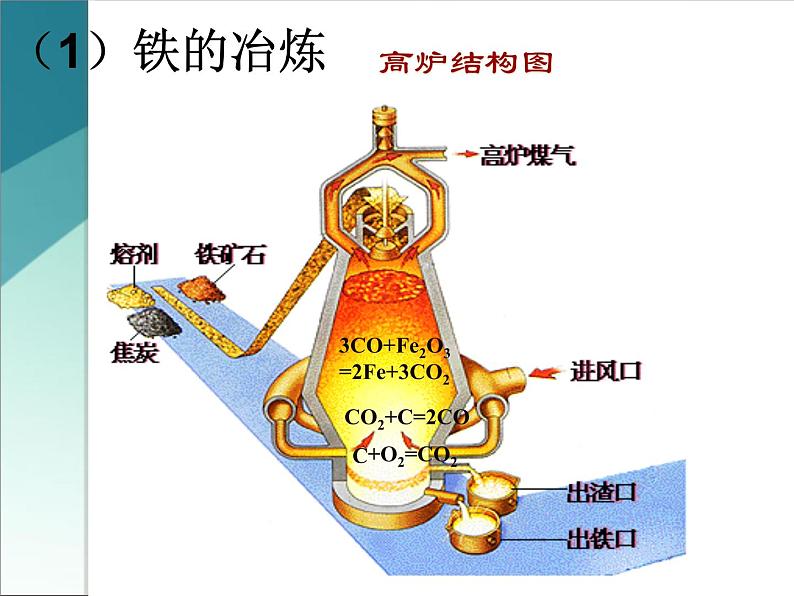
3CO+Fe2O3=2Fe+3CO2
思考:1、指出赤铁矿反应中何者为氧化剂,何者为还原剂。
2、试判断高炉气 、废渣有哪些主要成分?
高炉气:N2、CO、CO2;废渣:CaSiO3
铁矿石、焦炭、空气、石灰石
3、铁矿石中含有脉石(主要含有二氧化硅等),请写出形成炉渣(主要成分CaSiO3)的化学方程式
利用氧化还原反应,在高温下,用还原剂(主要是CO)从铁矿石中还原出铁。
(3)原料:铁矿石,焦炭,石灰石,空气
(4)炼铁的主要反应过程
(1)还原剂的形成 C+O2= CO2 CO2+C= 2CO(2)铁的还原 Fe2O3+3CO=2Fe+3CO2(3)炉渣的形成 CaCO3=CaO+CO2 CaO+SiO2=CaSiO3
1、反应原理 高温下,用氧化剂把生铁里过多的碳和其它杂质氧化成气体或炉渣而除去。2、目的: 降碳、调硅锰、去硫磷。3、主要反应(分三个阶段)
脱氧:用硅、锰或金属铝来还原钢水中含有的少量FeO2FeO+Si=SiO2+2Fe3FeO+2Al=3Fe+Al2O3FeO+Mn=Fe+MnO生成的二氧化硅等大部分形成炉渣而除去,部分的硅、锰等留在钢里以调整钢的成分。
脱硫:FeS+CaO=CaS+FeO
思考:炼钢原理(或过程)是怎样的,与炼铁原理有什么异同?
相同点:都是利用氧化还原反应。不同点:炼铁主要是用还原剂把铁从铁矿石中还原出来(侧重还原),而炼钢主要是用氧化剂把生铁中过多的碳和其它杂质氧化而除去(侧重氧化)。再添加硅、锰、铝等其他合金作为脱氧剂,以调整钢水的成分制成符合规定的钢材。
写出下列有关反应方程式。
Al2O3+2NaOH=2NaAlO2+H2O
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
6O2-—12e-=3O2
4Al3++12e-=4Al
在高温下,阳极产生的氧气会跟碳电极发生反应,生成二氧化碳,所以在电解中要定时补充碳块。铝的熔点是660℃,电冶铝反应的温度是1000℃左右。所以电解生成的铝呈液态,从电解装置的底部流出。
阅读课本第62-63页,了解各种合金材料
阅读课文P63,思考下列问题:1、金属的腐蚀包括几种类型?分别是什么?2、电化学腐蚀和化学腐蚀原理有何不同?在两者的腐蚀过程中是否有电流产生?
一般情况下,温度越高,金属腐蚀越快。
金属材料与其表面接触的物质直接发生化学反应.
(2)电化学腐蚀(腐蚀的主要原因)
不同金属或不纯金属与电解质溶液接触,因发生原电池反应,比较活泼金属失电子而被氧化,这种腐蚀叫做电化学腐蚀.
构成原电池的条件:前提:自发进行的氧化还原反应1、有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
2、两极材料均插入电解质溶液中。
3、两极相连形成闭合回路。
负极: 较活泼的金属正极: 较不活泼的金属或非金属导体
将化学能转为电能,相当于电源
[练习1] 下列哪些装置能构成原电池?
较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电路流向较不活泼的金属(正极) 。
中性溶液或酸性很弱——吸氧腐蚀(钢铁腐蚀的主要情况)
2H2O+O2+4e =4OH-
2H+ + 2e=H2↑
金属的化学腐蚀与电化学腐蚀
金属原子失去电子被氧化而消耗的过程: M-ne-=Mn+。
金属和其它物质直接接触发生氧化还原反应而引起的腐蚀
不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀
往往同时发生,但电化学腐蚀更普遍,速率更快。
3、试写出a、b中的电极反应和电池反应,以及溶液中生成铁锈的反应。填写下表:
2H++2e-==H2↑
O2+2H2O+4e-==4OH-
Fe - 2e- == Fe2+
2Fe+O2+2H2O == 2Fe(OH)2
Fe +2H+ == Fe2++H2↑
1、铁被腐蚀与什么物质有关?本质是什么?2、怎样才能防止铁生锈?最简单的方法是什么? 3、除了覆盖保护层外,还有哪些保护金属的方法,分别利用的什么原理?
是空气中O2与H2O共同作用的结果
本质都是铁失电子被腐蚀。
防止铁失电子,最简单就是隔绝空气和水,覆盖保护层。
2.金属腐蚀的防止和利用
金属与其接触的物质在一定条件下发生氧化还原反应而受到损害
金属腐蚀的防护方法
1.改变金属的内部结构
2.金属表面覆盖保护层
如油漆、油脂等,电镀Cr等易氧化形成致密的氧化物薄膜作保护层。
原理:隔绝金属与外界空气、电解质溶液的接触。
3.电化学保护法
原理:形成原电池反应时,让被保护金属做正极, 不反应,起到保护作用;而活泼金属发生氧化反应被腐蚀。
如将Cr、Ni等金属加进钢里制成合金钢。
一.改变金属的内部结构
钢铁发蓝处理、阳极氧化处理、离子注入、表面渗镀、
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的过程。
阴极——镀件 阳极——镀层金属电镀液——含有镀层金属离子的溶液
在铁制品上镀铜:阳极——铜 阴极——铁制品 电镀液——CuSO4溶液
阴极:Cu2++2e-=Cu 阳极:Cu-2e-=Cu2+
1:牺牲阳极的阴极保护法例:铁船表面涂上锌,当镀层有破损时···2:外加电流的阴极保护法用被保护的钢铁作阴极,惰性电极作阳极,外接直流电源
1.下列装置为电镀池的是 ( )
2.为除去镀在铝片表面上的铜镀层,而不使铝被腐蚀,可选用下列哪种试剂 ( ) A.浓硫酸 B.稀硫酸 C.浓硝酸 D.稀硝酸
3.下列叙述不正确的是 ( )A.金属的电化腐蚀比化学腐蚀普遍 B.钢铁在干燥的空气里不易被腐蚀C.用铝质铆钉接铁板,铁板易被腐蚀 D.原电池中电子由正极流入负极
思考:根据所学过内容思考交流金属的冶炼方法?
不同金属冶炼方法的选择
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag
工序:探矿、采矿、选矿、冶炼
3CO+Fe2O3=2Fe+3CO2
思考:1、指出赤铁矿反应中何者为氧化剂,何者为还原剂。
2、试判断高炉气 、废渣有哪些主要成分?
高炉气:N2、CO、CO2;废渣:CaSiO3
铁矿石、焦炭、空气、石灰石
3、铁矿石中含有脉石(主要含有二氧化硅等),请写出形成炉渣(主要成分CaSiO3)的化学方程式
利用氧化还原反应,在高温下,用还原剂(主要是CO)从铁矿石中还原出铁。
(3)原料:铁矿石,焦炭,石灰石,空气
(4)炼铁的主要反应过程
(1)还原剂的形成 C+O2= CO2 CO2+C= 2CO(2)铁的还原 Fe2O3+3CO=2Fe+3CO2(3)炉渣的形成 CaCO3=CaO+CO2 CaO+SiO2=CaSiO3
1、反应原理 高温下,用氧化剂把生铁里过多的碳和其它杂质氧化成气体或炉渣而除去。2、目的: 降碳、调硅锰、去硫磷。3、主要反应(分三个阶段)
脱氧:用硅、锰或金属铝来还原钢水中含有的少量FeO2FeO+Si=SiO2+2Fe3FeO+2Al=3Fe+Al2O3FeO+Mn=Fe+MnO生成的二氧化硅等大部分形成炉渣而除去,部分的硅、锰等留在钢里以调整钢的成分。
脱硫:FeS+CaO=CaS+FeO
思考:炼钢原理(或过程)是怎样的,与炼铁原理有什么异同?
相同点:都是利用氧化还原反应。不同点:炼铁主要是用还原剂把铁从铁矿石中还原出来(侧重还原),而炼钢主要是用氧化剂把生铁中过多的碳和其它杂质氧化而除去(侧重氧化)。再添加硅、锰、铝等其他合金作为脱氧剂,以调整钢水的成分制成符合规定的钢材。
写出下列有关反应方程式。
Al2O3+2NaOH=2NaAlO2+H2O
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
6O2-—12e-=3O2
4Al3++12e-=4Al
在高温下,阳极产生的氧气会跟碳电极发生反应,生成二氧化碳,所以在电解中要定时补充碳块。铝的熔点是660℃,电冶铝反应的温度是1000℃左右。所以电解生成的铝呈液态,从电解装置的底部流出。
阅读课本第62-63页,了解各种合金材料
阅读课文P63,思考下列问题:1、金属的腐蚀包括几种类型?分别是什么?2、电化学腐蚀和化学腐蚀原理有何不同?在两者的腐蚀过程中是否有电流产生?
一般情况下,温度越高,金属腐蚀越快。
金属材料与其表面接触的物质直接发生化学反应.
(2)电化学腐蚀(腐蚀的主要原因)
不同金属或不纯金属与电解质溶液接触,因发生原电池反应,比较活泼金属失电子而被氧化,这种腐蚀叫做电化学腐蚀.
构成原电池的条件:前提:自发进行的氧化还原反应1、有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
2、两极材料均插入电解质溶液中。
3、两极相连形成闭合回路。
负极: 较活泼的金属正极: 较不活泼的金属或非金属导体
将化学能转为电能,相当于电源
[练习1] 下列哪些装置能构成原电池?
较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电路流向较不活泼的金属(正极) 。
中性溶液或酸性很弱——吸氧腐蚀(钢铁腐蚀的主要情况)
2H2O+O2+4e =4OH-
2H+ + 2e=H2↑
金属的化学腐蚀与电化学腐蚀
金属原子失去电子被氧化而消耗的过程: M-ne-=Mn+。
金属和其它物质直接接触发生氧化还原反应而引起的腐蚀
不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀
往往同时发生,但电化学腐蚀更普遍,速率更快。
3、试写出a、b中的电极反应和电池反应,以及溶液中生成铁锈的反应。填写下表:
2H++2e-==H2↑
O2+2H2O+4e-==4OH-
Fe - 2e- == Fe2+
2Fe+O2+2H2O == 2Fe(OH)2
Fe +2H+ == Fe2++H2↑
1、铁被腐蚀与什么物质有关?本质是什么?2、怎样才能防止铁生锈?最简单的方法是什么? 3、除了覆盖保护层外,还有哪些保护金属的方法,分别利用的什么原理?
是空气中O2与H2O共同作用的结果
本质都是铁失电子被腐蚀。
防止铁失电子,最简单就是隔绝空气和水,覆盖保护层。
2.金属腐蚀的防止和利用
金属与其接触的物质在一定条件下发生氧化还原反应而受到损害
金属腐蚀的防护方法
1.改变金属的内部结构
2.金属表面覆盖保护层
如油漆、油脂等,电镀Cr等易氧化形成致密的氧化物薄膜作保护层。
原理:隔绝金属与外界空气、电解质溶液的接触。
3.电化学保护法
原理:形成原电池反应时,让被保护金属做正极, 不反应,起到保护作用;而活泼金属发生氧化反应被腐蚀。
如将Cr、Ni等金属加进钢里制成合金钢。
一.改变金属的内部结构
钢铁发蓝处理、阳极氧化处理、离子注入、表面渗镀、
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的过程。
阴极——镀件 阳极——镀层金属电镀液——含有镀层金属离子的溶液
在铁制品上镀铜:阳极——铜 阴极——铁制品 电镀液——CuSO4溶液
阴极:Cu2++2e-=Cu 阳极:Cu-2e-=Cu2+
1:牺牲阳极的阴极保护法例:铁船表面涂上锌,当镀层有破损时···2:外加电流的阴极保护法用被保护的钢铁作阴极,惰性电极作阳极,外接直流电源
1.下列装置为电镀池的是 ( )
2.为除去镀在铝片表面上的铜镀层,而不使铝被腐蚀,可选用下列哪种试剂 ( ) A.浓硫酸 B.稀硫酸 C.浓硝酸 D.稀硝酸
3.下列叙述不正确的是 ( )A.金属的电化腐蚀比化学腐蚀普遍 B.钢铁在干燥的空气里不易被腐蚀C.用铝质铆钉接铁板,铁板易被腐蚀 D.原电池中电子由正极流入负极













