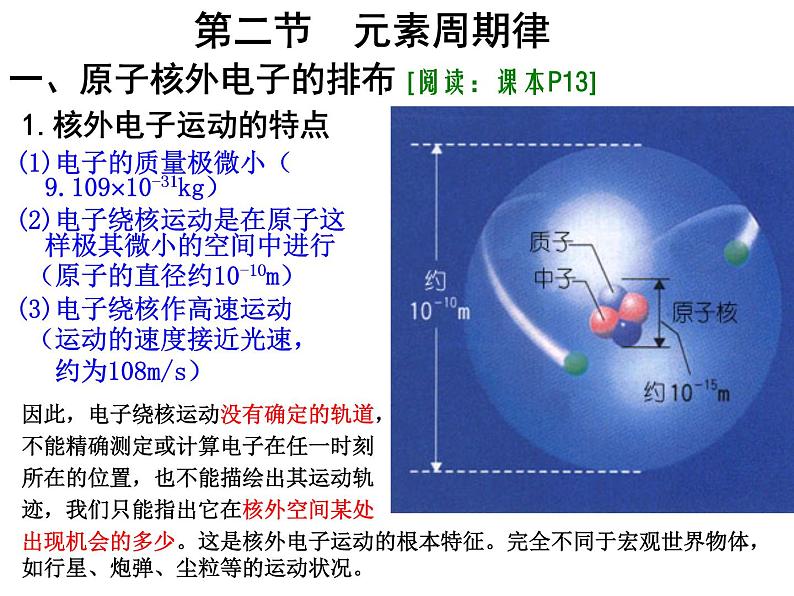


高中化学人教版 (新课标)必修2第二节 元素周期律课文内容ppt课件
展开
这是一份高中化学人教版 (新课标)必修2第二节 元素周期律课文内容ppt课件,共25页。PPT课件主要包含了核外电子受力分析,A能量最低原理,元素周期律,A周期性,B元素的性质,原子核外电子排布,原子半径,元素主要化合价,同周期同主族,原子半径大小比较等内容,欢迎下载使用。
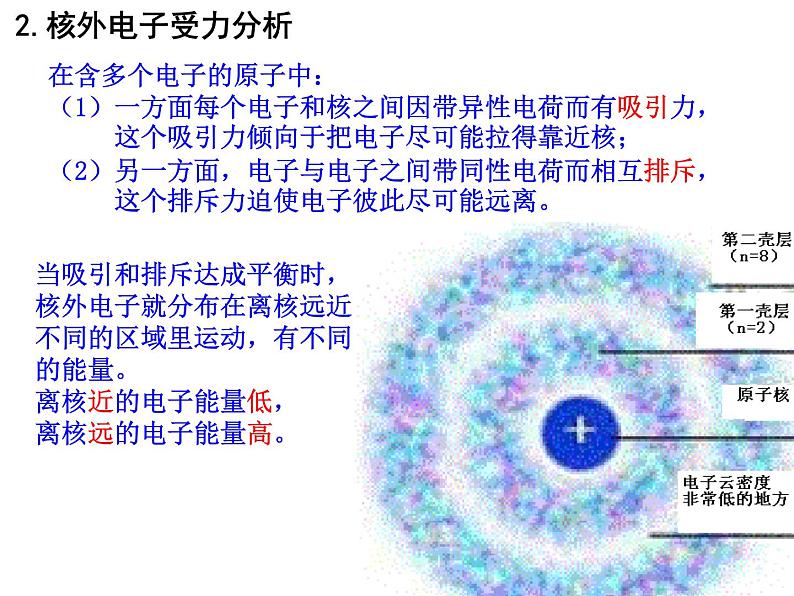
在含多个电子的原子中:(1)一方面每个电子和核之间因带异性电荷而有吸引力, 这个吸引力倾向于把电子尽可能拉得靠近核;(2)另一方面,电子与电子之间带同性电荷而相互排斥, 这个排斥力迫使电子彼此尽可能远离。
当吸引和排斥达成平衡时,核外电子就分布在离核远近不同的区域里运动,有不同的能量。离核近的电子能量低,离核远的电子能量高。
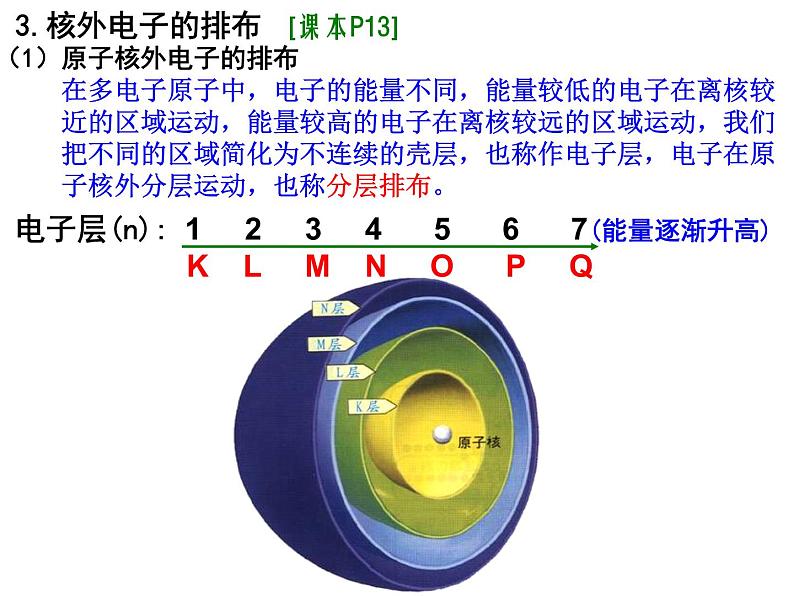
3.核外电子的排布 [课本P13]
在多电子原子中,电子的能量不同,能量较低的电子在离核较近的区域运动,能量较高的电子在离核较远的区域运动,我们把不同的区域简化为不连续的壳层,也称作电子层,电子在原子核外分层运动,也称分层排布。
(1)原子核外电子的排布
电子层(n): 1 2 3 4 5 6 7(能量逐渐升高) K L M N O P Q
(2)核外电子排布的规律 [学案P10左]
①各电子层最多容纳的电子数目是2n2②最外层电子数目不超过8个(K层为最外层时不超过2个)③次外层电子数目不超过18个, 倒数第三层电子数目不超过32个
原子核外的电子总是尽先排布在能量最低的的电子层里,然后再由里往外,依次排布在能量逐步升高的电子层里,即排满了K层才排L层,排满了L层才排M层。
B. 各电子层排布规律
注意:1.以上几点是互相联系的,不能孤立地理解。 如:当M层不是最外层时,最多可以排布18个电子, 而当它是最外层时,则最多可以排布8个电子。 2.该规律只适用于主族元素原子核外电子的排布 3.主族元素原子内层电子数目分别是:2、8、18、32
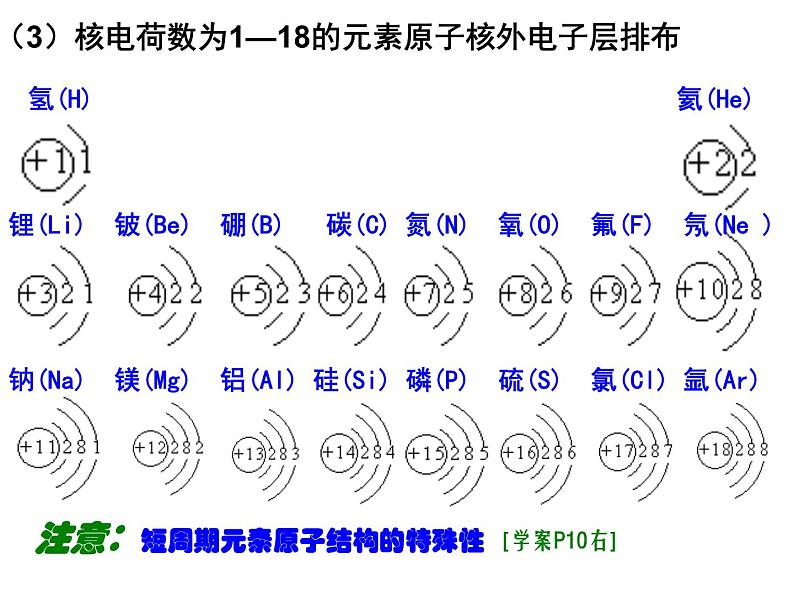
氢(H) 氦(He)
锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne )
钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S) 氯(Cl) 氩(Ar)
(3)核电荷数为1—18的元素原子核外电子层排布
注意:短周期元素原子结构的特殊性 [学案P10右]
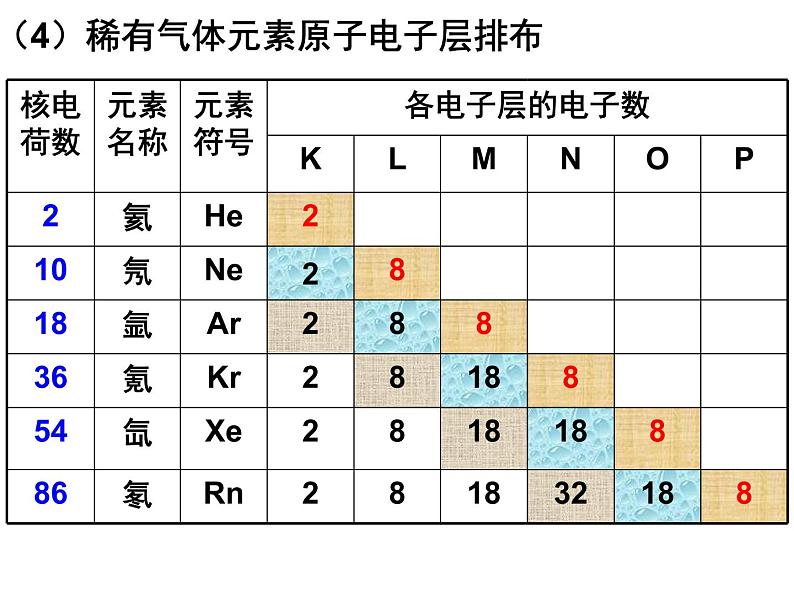
(4)稀有气体元素原子电子层排布
4.与稀有气体原子核外电子排布相同的离子 [设计P15右]
(1)与2He原子电子层结构相同的离子:
(3)与18Ar原子电子层结构相同的离子:
(2)与10Ne原子电子层结构相同的离子:
7N3-、8O2-、9F-、11Na+、12Mg2+、13Al3+
1H-、3Li+、4Be2+
阳离子:与上一周期稀有气体原子核外电子排布相同阴离子:与同周期稀有气体原子核外电子排布相同
15P3-、16S2-、17Cl-、19K+、20Ca2+
5.含有10个电子的常见粒子 [设计P16左下]
7N3-、8O2-、9F-、OH-、NH2-
15P3-、16S2-、17Cl-、HS-
10Ne、HF、H2O、NH3、CH4、
11Na+、12Mg2+、13Al3+、NH4+、H3O+
6.含有18个电子的常见粒子 [设计P16左下]
18Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6
19K+、20Ca2+
1、判断下列示意图是否正确?为什么? A、 B、 C、 D、
+54 2 8 18 20 6
2、某元素的原子核外有3个电子层,最外层有5个电 子,该原子核内的质子数为( ) A、14 B、15 C、16 D、173、某元素的原子核外有三个电子层,M层的电子数是L 层电子数的1/2,则该元素的原子是( ) A、Li B、Si C、Al D、K
4、按核外电子排布规律,预测核电荷数 为118的元素的原子核外电子层排布是( )A 2、8、18、32、58B 2、8、18、32、50、8C 2、8、18、32、50、18、8D 2、8、18、32、32、18、8
循环往复,自然界普遍存在该现象
如:时间——周期性,简单的重复
生物进化——周期性,螺旋上升
元素的金属性和非金属性 . . . . . .
(一)元素原子核外电子排布的周期性变化
从左至右,电子层数相同,最外层电子数依次增加
从上至下,最外层电子数相同,电子层数依次增加
(二)元素原子半径的周期性变化
主族元素原子半径的递变规律
同周期主族元素: 从左到右原子半径依次减小 (除稀有气体)
B. 同主族元素: 从上到下原子半径逐渐变大
从上到下:电子层数依次增加----- 原子半径越来越大
从左到右:核电荷数依次增加,最外层电子数依次增加---- 原子半径越来越小(零族除外)
2、离子半径大小的比较
(3)具有相同电子层结构的离子
从上到下:阴、阳离子半径逐渐增大
②从左到右:阴离子半径逐渐减小,阳离子半径逐渐减小
①阴离子半径大于阳离子半径
核电荷数越大,原子核对核外电子的吸引力越大,半径越小 10电子: 7N3- > 8O2- > 9F- >11Na+ > 12Mg2+ > 13Al3+ 18电子:16S2- > 17Cl- > 19K+ > 20Ca2+
3、同种元素的各种粒子半径大小比较
4、不同周期、主族、电子层结构也不相同的粒子 半径大小比较
核外电子数越多,微粒半径越大如:Fe>Fe2+ > Fe3+ ,Cl->Cl
找出其他元素作参照对比判断如Na+与S2-哪个大半径大小比较:可选F-、Cl-来对比,因为Na+Cl-, Cl->F-,所以S2->Na+。
Mg2+、Na+ 、 O2- 、N3-
K+、 CI-、 S2-、Ca2+
( S2- > S 、 AI > AI3+)
比较下列粒子半径的大小
(N3-> O2- > Na+> Mg2+)
( S2- > CI- > K+ > Ca2+ )
S2- 与 S 、 AI 与 AI3+
(三)元素化合价的周期性变化
2、化合价与主族序数的关系
(1)最高正价 = 最外层电子数 = 主族序数(2)︱最高正价︱+︱最低负价︱= 8(3)最低负价 = – (8 – 最外层电子数) = – (8 – 主族序数)
(1)金属无负价,氟无正价,氧无最高正价(2)稀有气体元素化学性质不活泼,通常情况下难 以与其他元素化合,规定其化合价为0(3)价电子:决定元素化合价的电子(外层电子)
从上到下,化合价一般相同
单质跟水或酸反应置换氢的难易
最高价氧化物对应水化物的碱性强弱
与H2反应的难易程度及氢化物稳定性强弱
最高价氧化物对应水化物的酸性强弱
非金属单质间的置换反应
1.判断元素金属性、非金属性强弱的方法
(四)元素金属性、非金属性的周期性变化
3.同周期元素金属性和非金属性的递变规律
最高价氧化物对应水化物的酸碱性
稀 有 气 体 元 素
金属性逐渐减弱,非金属性逐渐增强
4.元素的金属性和非金属性递变小结
+1→+7 -4→-1
最高正价=族序数(O、F除外)
相关课件
这是一份人教版 (新课标)必修2第二节 元素周期律多媒体教学课件ppt,共60页。PPT课件主要包含了Na+,-e-,Cl-,+e-,元素周期律的内容,元素周期律的实质等内容,欢迎下载使用。
这是一份化学必修2第三节 化学键示范课课件ppt,共57页。PPT课件主要包含了Na+,共价键小结等内容,欢迎下载使用。
这是一份人教版 (新课标)必修2第二节 元素周期律示范课ppt课件,共14页。PPT课件主要包含了了解两性元素,结构决定位置,原子得失电子的能力,位置决定性质,氧化性增强,非金属性逐渐增强,金属性逐渐增强,原子半径逐渐增大,还原性逐渐增强,原子半径逐渐减小等内容,欢迎下载使用。










