




人教版 (新课标)必修2第三节 化学键背景图ppt课件
展开
这是一份人教版 (新课标)必修2第三节 化学键背景图ppt课件,共30页。PPT课件主要包含了第三节化学键,离子键,化学键,氯化钠的形成过程,第二课时共价键等内容,欢迎下载使用。
那么是不是任意两种元素的原子之间都能结合成新的物质呢?
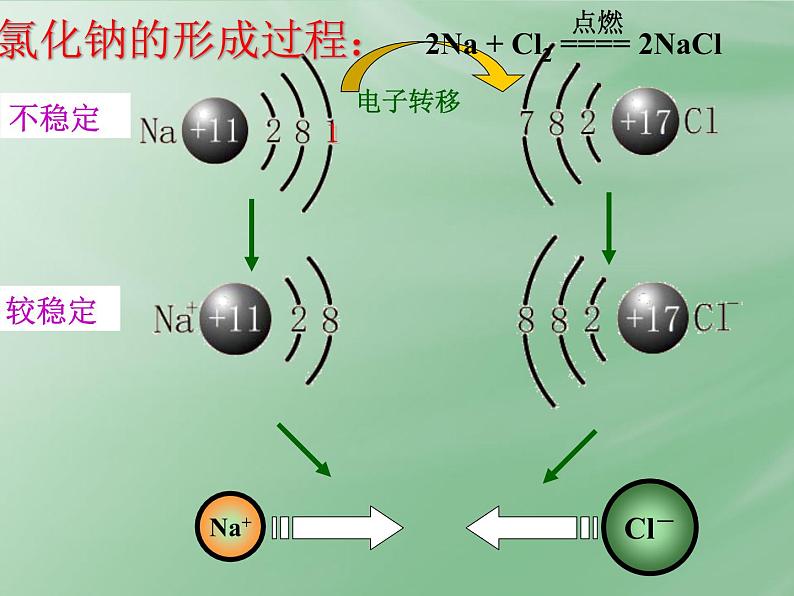
实验1—2:钠在氯气中燃烧
Na在Cl2中剧烈燃烧,生成的NaCl小颗粒悬浮在空气中呈白烟状
思考与交流: 试用原子结构知识解释NaCl是怎样形成的。
使阴阳离子结合成化合物的静电作用
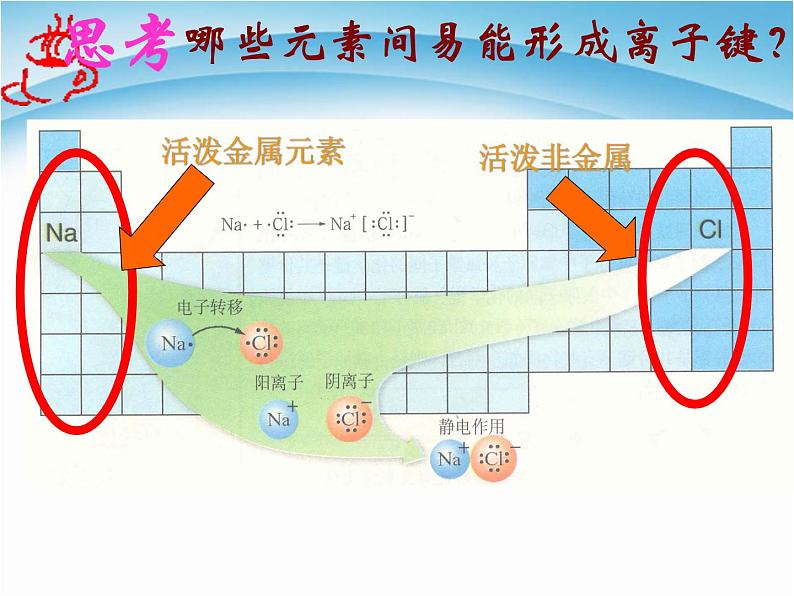
哪些元素间易能形成离子键?
活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)
特殊:AlCl3(共价键) 特殊:NH4+X-(离子键)
例如:NaCl、CaO、K2SO4、KOH等
凡是含有离子键构成的化合物就叫做离子化合物
特殊:AlCl3(共价化合物) 特殊:NH4+X-(离子化合物)
练习1. 下列说法正确的是: A.离子键就是使阴、阳离子结合成化合物的静电引力B.所有金属与所有非金属原子之间都能形成离子键 C.在化合物CaCl2中,两个氯离子之间也存在离子键D.钠原子与氯原子结合成氯化钠后体系能量降低
练习2. 下列各数值表示有关元素的原子序数,其所表示的各原子组中能形成离子化合物的的是: A.10与12 B.8与17 C. 11与17 D.6与14
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式
结论1:简单阳离子的电子式就是其离子符号
结论2:阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
1.下列电子式是否正确
2.写出下列粒子的电子式: 硫原子, 溴离子, 钾离子
5.离子化合物的电子式
结论3:离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能放一起
6.用电子式表示离子化合物的形成过程
结论4:用电子式表示离子化合物形成过程注意
①原子A的电子式 + 原子B的电子式→化合物的电子式
②不能把“→”写成“=”。
③用电子式表示物质与用电子式表示物质形成过程的区别
⑴ 用电子式表示氧化镁的形成过程
⑵ 用电子式表示硫化钾的形成过程
原子A的电子式 + 原子B的电子式 → 化合物的电子式
离子键:使阴、阳离子结合成化合物的静电作用. (成键粒子、成键条件)
静电作用 静电吸引=静电排斥
离 子 键 影 响 因 素 ①离子半径 ②离子电荷
活泼的金属元素和活泼非金属元素化合时形成离子键。请思考,非金属元素之间化合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子的倾向。
那么非金属元素之间是靠什么作用力结合在一起的呢?
我是非金属,我很少失电子
原子之间通过共用电子对所形成的相互作用,叫做共价键。
同种或不同种非金属元素之间
如:H2 N2 HCl H2O HF 等均以共价键形成分子
★氢分子的形成:
★氯化氢分子的形成:
共用电子对不偏移,成键原子不显电性
极性共价键:共用电子对偏向氯原子,氯原子带部分负电荷,氢原子带部分正电荷。
经典物质的电子式1.用电子式表示H2O、 N2、O2 、 CO2、NH3的形成过程,同时标出CO2、NH3、N2结构式2.写出CH4、CaCI2、HClO、H2O2、NaOH、Na2O2、NH4CI的电子式。
反思学习:通过上面这些典型物质的电子式的书写,想写以后书写物质的电子式时应注意什么,有什么心得。
1.首先要判断是形成离子键还是共价键
2.如果是形成共价键,共用的电子对数=8-最外层电子数
3.共用电子数多的原子通常放中心
课堂练习1.下列电子式书写正确的是( )
A.∶N∶∶∶N∶ B.H∶N∶H
C.H+[∶O∶]2-H+ D.Na+[∶Cl∶]-
课堂练习2.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )A.CO2
只含有共价键的化合物叫共价化合物
判断:HCl 、CO2 、 N2 、KCl、NaOH
离子化合物与共价化合物的比较
强碱、大多数盐、活泼金属的氧化物
酸、非金属氧化物、非金属的氢化物
熔融时不导电、水溶液部分导电
NH4+X-盐(离化)、AICI3(共化)
对应练习3:下列说法中正确的是( ) A.含有离子键的化合物必是离子化合物 B.具有共价键的化合物就是共价化合物 C.共价化合物可能含离子键 D.离子化合物中可能含有共价键E.有金属和非金属元素组成的化合物一定是离子化合物
注:离子化合物中一定含离子键也可能含有共价键共价化合物中一定含有共价键,一定不含离子键含有共价键的化合物不一定是共价化合物
阴、阳离子间的静电作用
原子间通过共用电子对所形成的相互作用
NH4+X-盐(离子键)、AICI3(共价键)
共价化合物和离子化合物和非金属单质
相关课件
这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键教学课件ppt,共39页。
这是一份鲁科版 (2019)必修 第二册第1节 化学键与物质构成图文ppt课件,共46页。PPT课件主要包含了内容索引,素养目标,原子离子,电化二元学说,共价键电子对,强相互作用,氢原子和氧原子间,氢原子和氯原子,氮原子和氢原子间,旧化学键断裂等内容,欢迎下载使用。
这是一份化学必修2第三节 化学键示范课课件ppt,共57页。PPT课件主要包含了Na+,共价键小结等内容,欢迎下载使用。









