






人教版 (新课标)必修2第一节 开发利用金属矿物和海水资源说课课件ppt
展开自然资源与可持续发展 广义地讲,所谓自然资源,是指在一定时间、地点的条件下能够产生经济价值的,以提高人类当前和将来福利的自然环境因素和条件的总称。 可持续发展的目标是满足人类需要,强调人类的行为要受到自然界的制约、强调代际之间、人类和其它生物种群之间、不同国家和不同地区之间的公平。它包括经济的可持续发展,社会的可持续发展、资源可持续发展、环境可持续发展和全球可持续发展。
金属元素种类多,分布广,活动性差别大,在自然界的存在形式各异,少数不活泼金属以游离态存在(如金和铂等),多数金属以化合态存在。
一、金属矿物的开发和利用 1.金属在自然界的存在形式
人们在生活和生产中使用的金属材料多是合金或纯金属,这就需要把金属从矿石中提炼(还原)出来,提炼的过程就是金属的冶炼过程。
金属的冶炼的步骤: 矿石的富集、冶炼、精炼
金属的活动性不同,可以采用不同的冶炼方法。总的来说,金属的性质越稳定,越容易将其从化合物中还原出来。金属冶炼的方法主要有:
① 热分解法(适合一些不活泼金属)
2HgO === 2Hg + O2 ↑
2Ag2O === 4Ag + O2 ↑
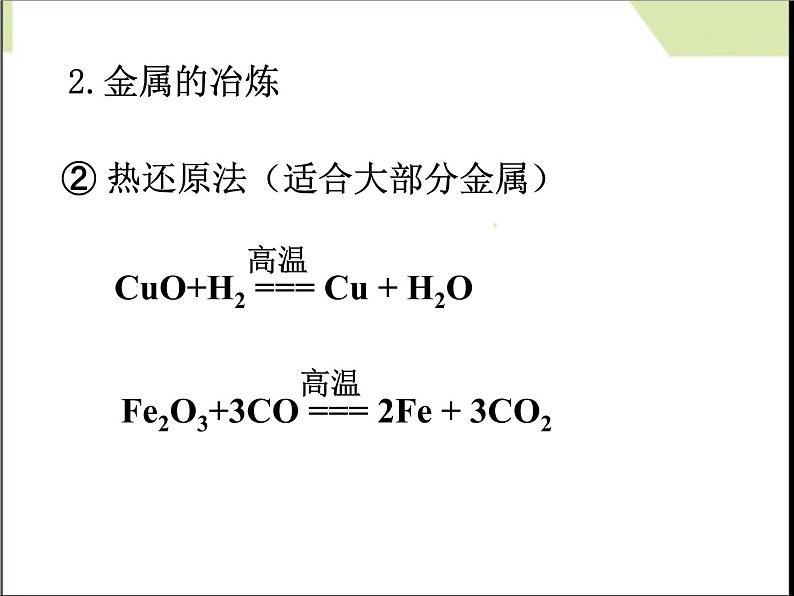
② 热还原法(适合大部分金属)
CuO+H2 === Cu + H2O
Fe2O3+3CO === 2Fe + 3CO2
③ 电解法(适合一些非常活泼金属)
MgCl2 (熔融) === Mg + Cl2 ↑
2Al2O3 (熔融) === 4Al + 3O2 ↑
2NaCl (熔融) === 2Na + Cl2 ↑
湿法炼铜 Fe+CuSO4 === FeSO4 + Cu
火法炼铜 Cu2S+O2 === 2Cu + SO2
小结:(1)热分解法适用于金属活动顺序中氢以后的金属冶炼或精炼;(2)热还原法适用于金属活动顺序中部的金属冶炼;(3)电解法适用于非常活泼的金属。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 电解法 热还原法 热分解 物理提取
反应现象:剧烈反应,发出强光,纸漏斗被烧穿,沙子上落有黑色铁珠。
Fe2O3+2Al === 2Fe + Al2O3
3MnO2+4Al === 3Mn+ 2Al2O3
Cr2O3+2Al === 2Cr + Al2O3
3C3O4+8Al === 9C + 4Al2O3
利用铝的还原性获得高熔点金属单质的方法。 是铝与某些金属氧化物在高热条件下发生的反应。其中镁条为引燃剂,氯酸钾为助燃剂 .
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等
3.有效利用金属资源的途径
减少金属的使用量;提高金属矿物的利用率;加强金属资源的回收和再利用;使用其他材料代替金属材料。
二、海水资源的开发利用
海洋约占地球表面积的71%。海水中水的储量约为1.3×109亿吨,约占地球总水量的97%。海水中除了水以外,还含有很多种常量元素和微量元素。
由于与岩石、大气和生物的相互作用,海水中溶解和悬浮着大量的无机物和有机物,按含量计,H2O中的H、O两种元素,加上Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr等11种元素超过总量的99%,其他为微量元素,总计含有80多种元素。
虽然海水中元素种类很多,总储量很大,但许多元素的富集程度却很低。例如,海水中金元素的总储量约为5×107t,而1t海水中的含量仅有4×10-6g。 总之,海洋是一个远未完全开发的巨大化学资源宝库。
海水中水资源的利用,主要包括海水的淡化和直接利用海水进行循环冷却等。
通过海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
海水淡化的方法及其特点
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
海水淡化与化工生产结合、与能源技术结合(1)海水制盐;(2)从海水中提取含氯、镁、钾、溴等化工原料及其化工产品;(3)从海水中获取铀和重水作为核能开发的重要原料;(4)从海水中获得其他物质和能量。如海洋药物及潮汐能、波浪能等新型能源的开发。
2、海水化学资源的开发利用
称取3g干海带,用刷子把干海带表面的附着物刷净(不要用水洗,有I-)。 将海带剪碎,用酒精润湿(便于灼烧)后,放在坩埚中。用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,停止加热,冷却;将海带灰转移到小烧杯中,再向烧杯中加入10ml蒸馏水,搅拌,煮沸2min-3min,过滤;向滤液中滴入几滴硫酸,再加入约1ml H2O2溶液,观察现象。取少量上述滤液,滴加几滴淀粉溶液,观察现象。
实验现象: 加入H2O2溶液后,溶液由无色变为深黄色;加入淀粉溶液后,溶液又变为深蓝色。
化学方程式:2KI + H2O2 + H2SO4=== I2+ K2SO4 + 2H2O
用蒸馏法将海水浓缩,用硫酸将浓缩的海水酸化。向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内。向吸收塔中溶液内通入适量的氯气。用CCl4萃取吸收塔中溶液里的溴单质。
人教版 (新课标)必修2第一节 开发利用金属矿物和海水资源图片ppt课件: 这是一份人教版 (新课标)必修2第一节 开发利用金属矿物和海水资源图片ppt课件,共27页。PPT课件主要包含了学习目标,重点难点,科学视野,海洋生物资源,海水中的化学资源,海洋中的矿产资源,海水资源的广泛性,交流·研讨,海水资源的分散性,海水资源的利用等内容,欢迎下载使用。
人教版 (新课标)必修2第一节 开发利用金属矿物和海水资源复习课件ppt: 这是一份人教版 (新课标)必修2第一节 开发利用金属矿物和海水资源复习课件ppt,共60页。PPT课件主要包含了课堂互动讲练,探究整合应用,知能优化训练,第一节,课前自主学案,学习目标,游离态,化合态,氧化还原,冶炼方法等内容,欢迎下载使用。
人教版 (新课标)必修2第一节 开发利用金属矿物和海水资源教案配套ppt课件: 这是一份人教版 (新课标)必修2第一节 开发利用金属矿物和海水资源教案配套ppt课件,共23页。PPT课件主要包含了学习目标,重点难点,科学视野,思考·交流,金属的冶炼,矿石的富集,合适的冶炼方法,如何精炼,交流·研讨,矿石中的金属是等内容,欢迎下载使用。













