








高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质图片ppt课件
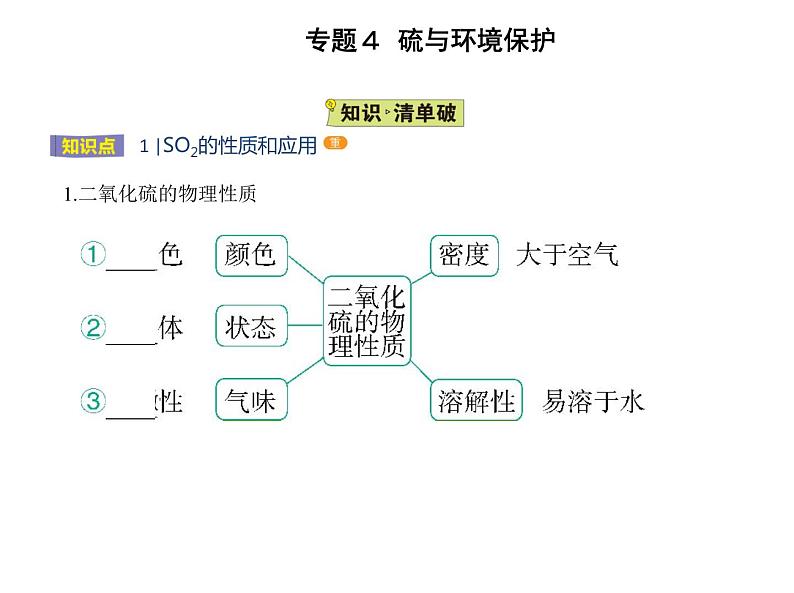
展开1.二氧化硫的物理性质
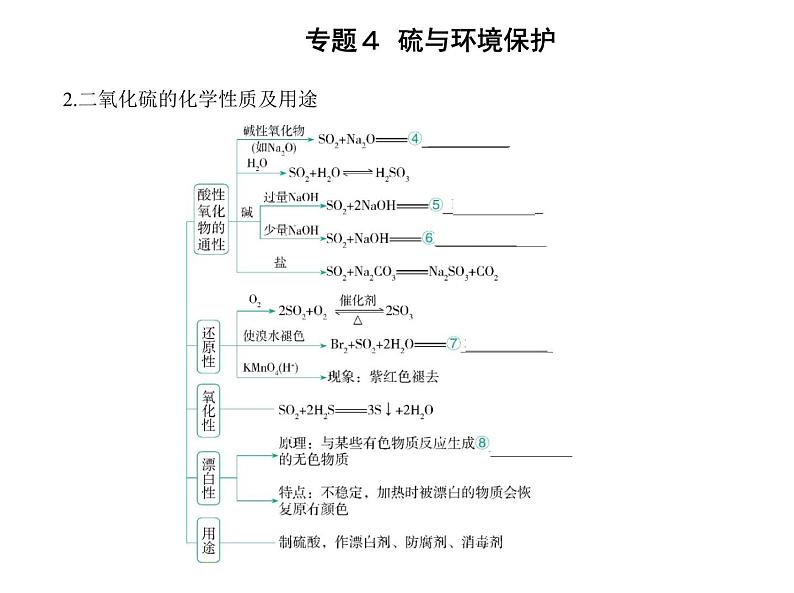
2.二氧化硫的化学性质及用途
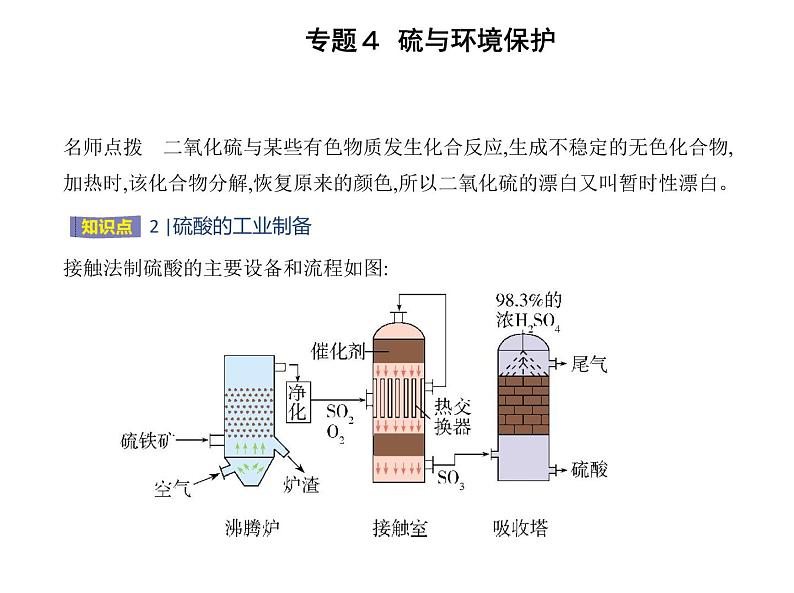
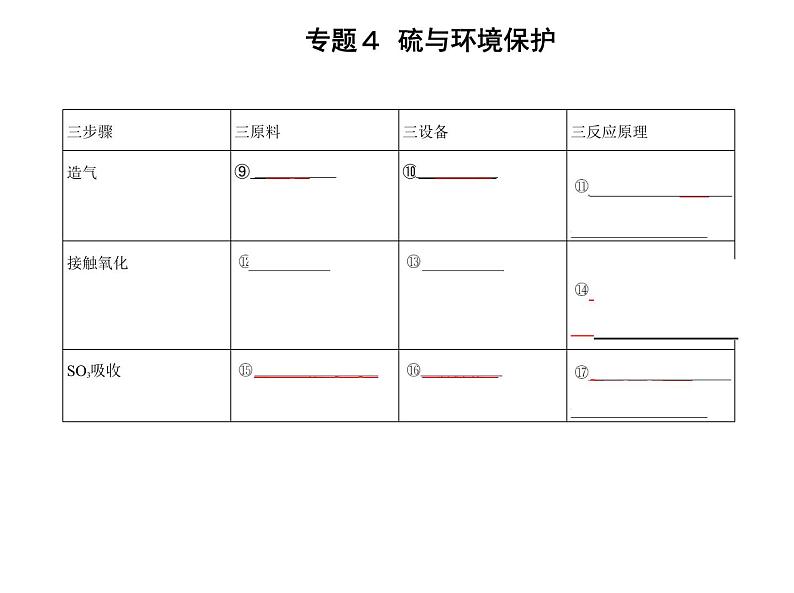
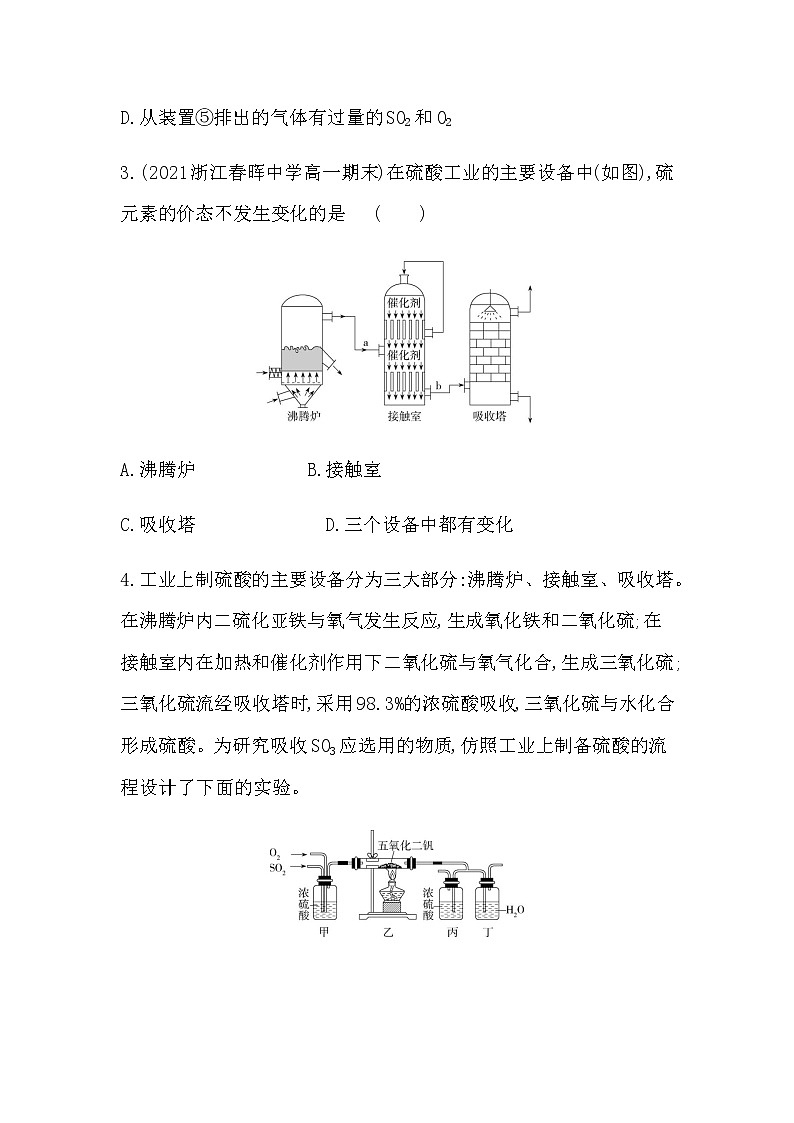
名师点拨 二氧化硫与某些有色物质发生化合反应,生成不稳定的无色化合物, 加热时,该化合物分解,恢复原来的颜色,所以二氧化硫的漂白又叫暂时性漂白。 接触法制硫酸的主要设备和流程如图:
1.二氧化硫是最常见、最简单、有刺激性气味的硫氧化物,为无色气体,是大气主 要污染物之一。SO2能使品红溶液和溴水褪色,这是因为SO2具有漂白性 ( ✕ )2.储运浓硫酸的槽车一般是铁制或铝制的,这是因为在常温下铝、铁遇浓硫酸会 发生钝化。说明在常温下铝、铁不会与浓硫酸发生反应 ( ✕ )3.将浓硫酸滴加到胆矾(CuSO4·5H2O)中,发现固体由蓝色变为白色,这体现了浓硫 酸的脱水性 ( ✕ )提示:体现了浓硫酸的吸水性,而非脱水性。4.在葡萄糖固体中加入浓硫酸可观察到固体发黑,产生大量气泡,形成黑色面包 状。该过程中浓硫酸表现了脱水性和强氧化性 ( √ )
5.可以用澄清石灰水鉴别SO2和CO2 ( ✕ )6.SO2可使溴水褪色,SO2表现漂白性 ( ✕ )7.SO2气体通入澄清石灰水或BaCl2溶液中均能产生白色沉淀 ( ✕ )提示:SO2不能与BaCl2发生反应,所以不会出现生成沉淀的现象。8.浓硫酸有吸水性,所以浓硫酸可用作干燥剂,如用于干燥NH3 ( ✕ )提示:浓硫酸有吸水性,所以浓硫酸可用作干燥剂,但NH3能与硫酸反应,所以不能 用于NH3的干燥。
材料一 二氧化硫是国内外允许使用的一种食品添加剂,在食品工业中扮演保 鲜、防腐、抗氧化的角色。SO2是在葡萄酒生产中普遍使用的添加剂。大多数 国家对食品中二氧化硫的含量都有着明确的规定,而且葡萄酒中的二氧化硫含量 大约只有干果中二氧化硫含量的十分之一。SO2在葡萄酒生产工艺中的主要作 用有以下几点:1.杀菌。不同的微生物对SO2的耐受性不同,其中细菌最为敏感,其 次为柠檬型酵母,酿酒酵母耐受性最强。因此可使用SO2来选择发酵微生物。2. 通过抑制微生物活性,推迟发酵开始时间。3.抗氧化。SO2可抑制氧化酶的作用, 防止酒体因被氧化而变色。4.增酸。调节发酵基质达到合适的酸度。
材料二 二氧化硫具有漂白性。工业上常用二氧化硫来漂白纸浆及草编织物 等。二氧化硫的漂白作用是由于它能与某些有色物质生成不稳定的无色物质,这 种无色物质受热容易分解而恢复原来的颜色,因此用二氧化硫漂白过的草帽辫日久又变成黄色。二氧化硫也被一些不法厂商非法用来加工食品,以使食品增白。 这类食品中SO2含量超标,对人体的肝、肾脏等有严重损伤,并有致癌作用。
问题1.葡萄酒生产中少量SO2的作用是什么?提示:一是利用了SO2的还原性,作抗氧化剂;二是利用SO2的毒性,作杀菌剂;三是 通过抑制微生物活性,推迟发酵开始时间;四是增酸。2.SO2可以使滴有酚酞的NaOH溶液、酸性KMnO4溶液以及品红溶液褪色,分别体 现了SO2的什么性质?提示:SO2与NaOH溶液反应体现SO2酸性氧化物的性质;SO2能够与KMnO4发生氧 化还原反应,体现SO2的还原性;SO2使品红溶液褪色,体现SO2的漂白性。3.将SO2气体通入澄清石灰水中,会看到溶液变浑浊,继续通入又变澄清。如何用 化学方程式表示反应原理?如何鉴别SO2和CO2?
提示:化学方程式为SO2+Ca(OH)2 CaSO3↓+H2O、CaSO3+SO2+H2O Ca(HSO3)2。SO2与CO2均能使澄清石灰水变浑浊,所以不能用澄清石灰水鉴别二者, 可用酸性KMnO4溶液或溴水鉴别,SO2能使这两种溶液褪色,CO2不能。
常见漂白剂的漂白原理及漂白特点
某化学课外小组利用下图装置探究SO2的性质。 请回答下列问题:(1)装置甲中高锰酸钾溶液褪色可以证明SO2具有 。(2)装置乙中发生反应的化学方程式为 ;可以证明SO2具有 。(3)从环保的角度考虑,该装置尾部需要连接一个盛有 (填化学式)溶液的 洗气瓶。
解析 (1)酸性高锰酸钾具有强氧化性,而SO2中S是+4价既具有氧化性也具有还 原性,因此当SO2遇到强氧化性的物质时表现还原性。(2)H2S中S是-2价的,H2S与 SO2发生氧化还原反应:2H2S+SO2 3S↓+2H2O;SO2中硫元素的化合价降低,表现氧化性。(3)SO2有毒,对空气有污染,且SO2是酸性气体,因此一般用碱液吸收,如 NaOH溶液、KOH溶液等。答案 (1)还原性 (2)2H2S+SO2 3S↓+2H2O 氧化性 (3)NaOH
易错警示SO2能使多种典型的有色试剂褪色,如KMnO4溶液、溴水、品红溶液、含有酚酞 的NaOH溶液等,但需要明确在相应有色溶液褪色时所表现出来的性质。SO2使 KMnO4溶液、溴水褪色表现的是还原性,使品红溶液褪色表现漂白性,使含有酚 酞的NaOH溶液褪色表现的是酸性氧化物的通性。
材料一 2019年1月12日凌晨2时左右,金丽温高速公路上,一辆运输6吨、98%浓 硫酸的货车与另一辆货车发生追尾事故,造成部分浓硫酸泄漏,事发时正下着毛 毛细雨。接到事故警报后,专业的化工抢险人员冲到了抢险的第一线,为防止泄 漏的浓硫酸灼伤皮肤,抢险人员都穿上了防化服;为防止稀释后的浓硫酸影响附 近铁路和周边环境,此次处置采取了堆土筑坝、封闭附近雨水口等措施,将浓硫 酸控制在指定范围内,并用熟石灰、碱液中和。经过一线人员连夜冒雨抢险,当 天8时08分,抢险基本结束,主线路恢复正常通行。
问题1.材料一可以得出浓硫酸有哪些性质?提示:浓硫酸有酸性、吸水性、脱水性及强氧化性,浓硫酸遇水放出大量的热。2.材料二中的用途能体现硫酸的哪些性质(写出两点即可)?提示:制化肥、酸洗等体现了硫酸的强酸性;作干燥剂体现了浓硫酸的吸水性。3.如果皮肤上不慎沾上浓H2SO4,正确的处理方法是什么?提示:用大量的水冲洗,最后涂抹上少量小苏打水或肥皂水。
浓H2SO4的强氧化性(1)Fe、Al的钝化常温下,Fe、Al遇浓硫酸表面会生成一层致密的氧化膜而“钝化”。(2)与金属活动性顺序中氢之前的活泼金属反应如:Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O。规律:①浓硫酸既表现氧化性,又表现酸性;②浓硫酸变稀后,会发生反应:Zn+H2SO 4 ZnSO4+H2↑。(3)与金属活动性顺序中氢之后的不活泼金属(除Au、Pt外)反应如:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。规律:①反应需加热才能发生;②氧化产物是硫酸盐,金属显较高价态,还原产物为 SO2;③浓硫酸既表现氧化性,又表现酸性;④随着反应的进行,硫酸浓度变小,变为 稀硫酸时,反应就会停止。
(4)与非金属反应如:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。规律:①反应需要加热才能发生;②氧化产物是含氧酸或非金属氧化物,还原产物 为SO2;③浓硫酸只表现氧化性;④随着反应的进行,硫酸浓度变小,变为稀硫酸时, 反应就会停止;⑤浓硫酸不能氧化H2、N2、O2、Si、Cl2、F2、Br2等。
某同学设想用如图装置来验证浓硫酸的某些性质,其中不能达到实验目的的是 ( )
高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第一单元 含硫化合物的性质教学课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册专题4 硫与环境保护第一单元 含硫化合物的性质教学课件ppt,共14页。PPT课件主要包含了温故知新,游离态和化合态,NaHSO3,回顾思考,硫单质的性质,物理性质,化学性质,与金属反应,跟非金属反应,跟碱溶液反应等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质公开课ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质公开课ppt课件,共28页。PPT课件主要包含了学习目标,知识回顾,硫酸的工业制法,三种原料,三套设备,主要反应,主要设备,沸腾炉,接触法制硫酸,接触室转化器等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质教案配套ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质教案配套ppt课件,共39页。PPT课件主要包含了学业基础,黑火药,刺激性,无明显,白色沉淀,H2SO4,不稳定的无色物质,答案B,C中溴水褪色,B中出现淡黄色沉淀等内容,欢迎下载使用。













