












苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用课文ppt课件
展开(1)概念:物质中① 直接相邻 的原子或离子之间存在的强烈的相互作用叫作 化学键。(2)类型:② 离子键 和③ 共价键 是两种常见的化学键。 2.离子键(1)概念:阴、阳离子之间存在的强烈的相互作用。(2)构成离子键的粒子是④ 阳离子和阴离子 。(3)离子键的实质是⑤ 静电作用 。
3.离子化合物(1)概念:由阴、阳离子构成的化合物。(2)常见的离子化合物的类型①活泼金属氧化物:Na2O、MgO等;②绝大多数盐:NaCl、K2SO4、CaCO3等;③强碱:NaOH、Ba(OH)2等。
1.电子式在元素符号周围用“·”或“×”来表示原子或离子的⑥ 最外层电子 的式 子。 2.电子式的书写(1)原子钠原子:⑦ Na· ;镁原子:⑧ ·Mg· 。(2)阳离子钠离子:⑨ Na+ ;铵根离子:⑩ 。
(3)阴离子氯离子: ;硫离子: 。(4)离子化合物氯化钠: 。 1.共价键(1)共价键的定义原子间通过 共用电子对 所形成的 强烈 的相互作用称为共价键。(2)成键微粒: 原子 。
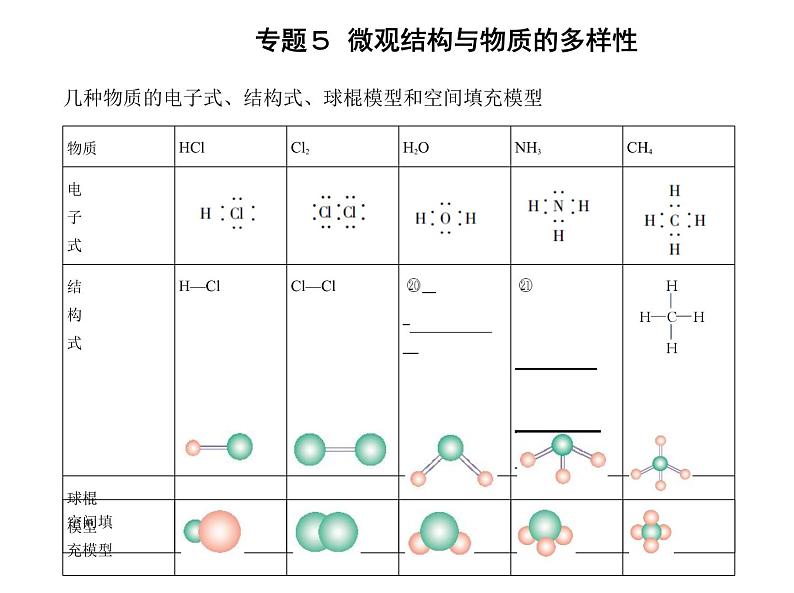
(3)共价键的实质是 静电作用 。 2.共价化合物(1)概念:原子间全部以 共价键 结合形成的化合物。(2)常见的共价化合物①非金属氢化物:如HCl、H2O等;②部分非金属氧化物:如CO2、SO3等;③含氧酸:如H2SO4、HNO3等;④绝大多数有机化合物:如甲烷、乙酸等。 3.共价分子的表示方法(1)电子式:如H∶H、 。(2)结构式:在结构式中常用一条短线表示一对共用电子对,如H—Cl等。(3)可以用球棍模型、空间填充模型表示共价分子的 空间结构 。
几种物质的电子式、结构式、球棍模型和空间填充模型
1.分子间作用力
温馨提示 干冰升华、硫晶体熔化、液氯汽化等过程中均需要吸收能量破坏分子间作用力。 2.氢键(1)概念:在有些分子之间还存在一种特殊的分子间作用力,称为氢键。(2)强度:一般的分子间作用力<氢键<化学键。(3)对物质性质的影响:分子间氢键使物质的熔、沸点 升高 。拓展提高 NH3和水分子间能形成氢键,使NH3在水中溶解度增大,通常条件下,1 体积水约能溶解700体积氨气。
1.化学键是指直接相邻的原子或离子之间存在的强烈的相互作用,包括静电吸引 作用和静电排斥作用( √ )2.离子化合物中一定含有离子键;含有离子键的化合物一定是离子化合物;离子化 合物中一定含有阴离子和阳离子;含有金属元素的化合物不一定是离子化合物,离子化合物中不一定含有金属元素 ( √ )3.原子间全部以共价键结合的分子称为共价分子,共价分子可以是单质分子,也可 以是化合物分子 ( √ )4.含有共价键的化合物一定是共价化合物 ( ✕ )提示:离子化合物中也可能含有共价键,如NaOH。5.单质溶于水,分子内共价键不被破坏 ( ✕ )提示:Cl2、F2等溶于水时能与水发生反应,分子内共价键被破坏。6.最外层只有一个电子的元素原子跟卤素原子结合时,形成的化学键一定是离子 键 ( ✕ )提示:卤化氢分子内都是共价键。
化学反应的实质是旧化学键断裂和新化学键形成的过程。判断一个反应是否为 化学反应的依据是反应是否生成新的物质。由化学键理论可知,又可根据一个变 化过程中是否有旧键的断裂和新键的生成来判断其是否为化学反应。判断化学 反应中化学键的变化情况,首先要明确物质中化学键的类型。
图1 图2
问题1.离子键、共价键与离子化合物、共价化合物有什么联系?提示:离子化合物中一定含有离子键,可能含有共价键;共价化合物中只含有共价 键。含有离子键的物质一定是离子化合物,含有共价键的物质可能是共价化合 物、离子化合物、单质等。2.观察图1所示的过程,分析有化学键断裂或有化学键形成的过程一定是化学反 应吗?提示:不一定。HCl溶于水,共价键被破坏,这个过程是物理变化。3.观察图2所示的过程,总结化学反应中化学键的变化情况。并据此分析:2Na2O2+ 2CO2 2Na2CO3+O2反应过程中化学键断裂、形成的情况。提示:根据图2所示,化学反应就是将反应物中的旧化学键断裂,再形成生成物中的
新化学键。反应2Na2O2+2CO2 2Na2CO3+O2中,要断裂Na2O2中的离子键、共价键,CO2中的共价键,再形成Na2CO3中的离子键、共价键和O2中的共价键。
物质变化过程中化学键的变化(1)化学反应过程①化学反应过程中反应物一定有化学键被破坏,产物中有新化学键的形成。②化学反应时,并不是反应物中所有的化学键都被破坏,如反应Na2SO4+BaCl2 BaSO4↓+2NaCl中,Na2SO4、BaCl2中的离子键被破坏,但S 中共价键未被破坏。(2)离子化合物的溶解或熔化过程(一般情况)离子化合物 电离 阴、阳离子。(3)共价化合物的溶解或熔化过程①溶解过程
(4)单质的熔化、升华或溶解过程
下列各组物质中化学键的类型完全相同的是 ( )A.HCl、MgCl2 B.H2O、Na2OC.CaCl2、NaOH D.NH3、CO2解析 HCl中是共价键,而MgCl2中是离子键,化学键的类型不相同,A错误;H2O中 是共价键,而Na2O中是离子键,化学键的类型不相同,B错误;CaCl2中是离子键而 NaOH中有离子键、共价键,化学键的类型不完全相同,C错误;NH3和CO2中均含 有共价键,化学键的类型完全相同,D正确。
氮化钠是一种非常不稳定的化合物,它是不可能用传统的固相反应制备的。2002 年,马克斯-普朗克学会的Dieter Fischer及Martin Jansen用钠及氮的原子束在液态 氮冷却的低温蓝宝石上沉积出氮化钠。氮化钠属于碱金属氮化物,又称离子型氮 化物,它的热稳定性较低。氮化钠遇水会产生NH3和NaOH。
问题1.怎样用电子式表示氮化钠的形成过程?提示:氮化钠是离子化合物,书写时注意电子的转移。2.原子间通过共用电子对达到了稳定的电子层结构,怎样理解稳定结构?提示:在共价分子中,稳定结构是指各原子最外层都达到了最多能容纳的电子数, 一般最外层达到8电子(当第1层为最外层时达到2电子)。3.MgF2的电子式写为Mg2+[: : ,正确吗?提示:不正确。应写为[: :]-Mg2+[: :]-
高中化学第二单元 微粒之间的相互作用说课ppt课件: 这是一份高中化学第二单元 微粒之间的相互作用说课ppt课件,共22页。PPT课件主要包含了要点一离子键,要点二离子化合物,要点三电子式等内容,欢迎下载使用。
化学必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用作业课件ppt: 这是一份化学必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用作业课件ppt,共18页。PPT课件主要包含了B级关键能力提升练,离子键,C级学科素养创新练等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用多媒体教学课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用多媒体教学课件ppt,共53页。PPT课件主要包含了离子键,答案D,课堂小结等内容,欢迎下载使用。













