












高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物多媒体教学课件ppt
展开钠原子的最外电子层只有1个电子,结构示意图为① ,在化学反应 中钠原子很容易失去最外层的1个电子,形成具有稳定电子层结构的钠离子,钠离 子结构示意图为② 。
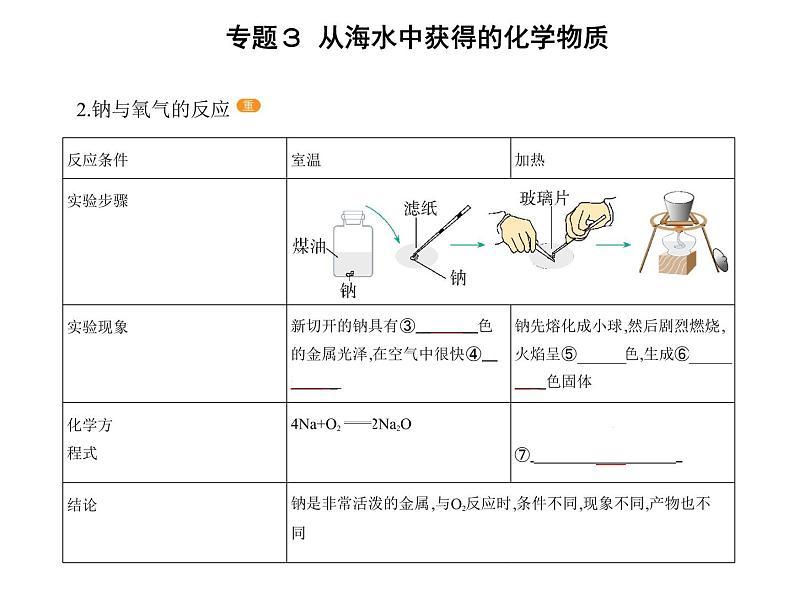
2.钠与氧气的反应
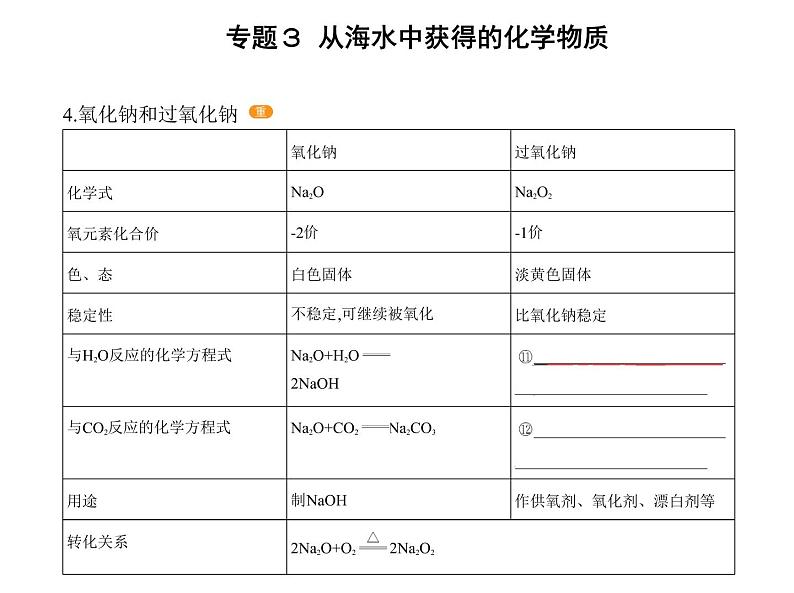
4.氧化钠和过氧化钠
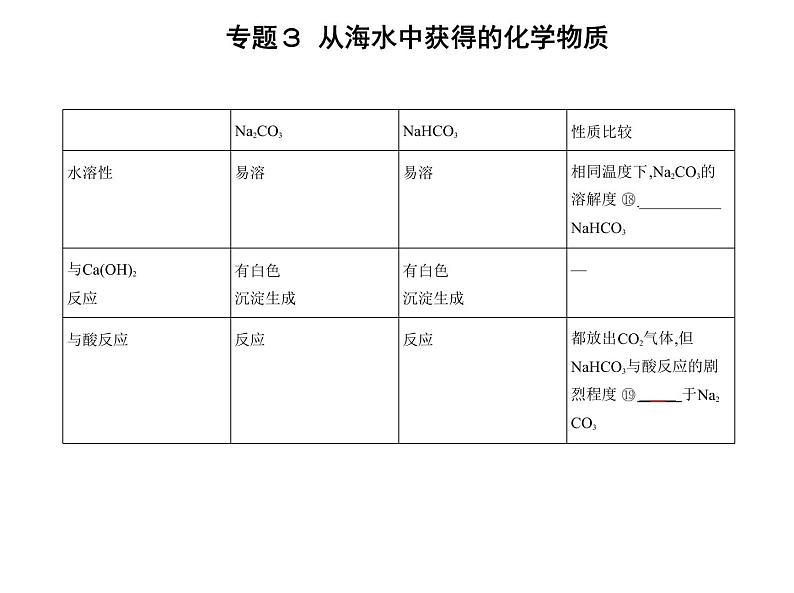
5.钠的制备工业上通常采用电解熔融NaCl的方法制取单质钠,化学方程式为 2NaCl(熔融) 2Na + Cl2↑ 。 1.碳酸钠的物理性质(1)物理性质颜色、状态:白色固体;水溶性:易溶;俗名: 纯碱 或苏打。(2)用途纯碱是一种非常重要的化工原料,在玻璃生产、制皂、造纸、纺织等工业中有广 泛应用。在日常生活中,常用热的Na2CO3溶液去除物品表面的油污。
2.碳酸氢钠的性质和应用(1)物理性质溶解性:易溶;俗名: 小苏打 。(2)用途发酵粉的主要成分之一是 NaHCO3 ,该物质在医疗上可用于治疗 胃酸过多 。3.碳酸钠与碳酸氢钠的性质比较
1.强电解质和弱电解质的比较
2.离子反应 概念:有 离子参加 的化学反应。3.离子方程式的书写步骤
4.离子方程式的意义(1)表示某一特定的化学反应例如,离子方程式Cu2++2OH-+Ba2++S BaSO4↓+Cu(OH)2↓只表示 Ba(OH)2+CuSO4 BaSO4↓+Cu(OH)2↓ 这一化学反应。(2)表示同一类化学反应例如,离子方程式H++OH- H2O可以表示 强酸和强碱在溶液中反应生成可溶性盐和水的中和反应 。
1.戴维电解熔融的苛性钾并在阴极上获得了金属钾后,他又电解熔融态的碳酸钠 获得了金属钠。在电解碳酸钠时,金属钠应该在阴极析出,钠元素被还原 ( √ )2.Na2O2是一种淡黄色粉末或颗粒,用于漂白动植物纤维、羽毛等,可作织物的印 染剂、空气中二氧化碳的吸收剂等。Na2O2与H2O或CO2反应均会有O2产生 ( √ )
3.根据侯氏制碱法,要制纯碱,需要先制得溶解度较小的NaHCO3,再利用碳酸氢钠 的不稳定性分解得到纯碱 ( √ )4.Na2O和Na2O2中氧元素的化合价分别为-2价和-1价 ( √ )5.CuSO4与Ba(OH)2溶液反应的离子方程式为Ba2++S BaSO4↓ ( ✕ )
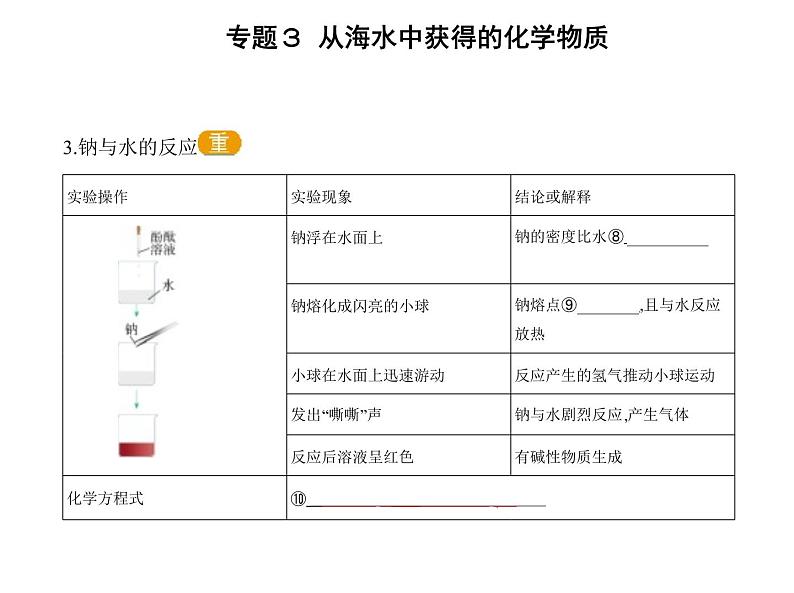
锂电池在我们日常生活中已经广泛应用。复旦大学团队研发了一种新型电池— —钠电池。英国皇家化学学会预言钠电池未来可能取代锂电池。跟锂电池相比, 钠电池具有一定的优势,如钠比锂便宜,而且地球上钠的含量比锂多。但在钠电 池应用中,因为金属钠与水反应会产生一系列的问题,导致生产成本增加。问题1.钠电池有什么局限性?提示:钠能够与水反应,化学方程式为2Na+2H2O 2NaOH+H2↑。 2.初中时我们知道活泼的金属能够与酸反应生成氢气,活泼金属还可以把不活泼 金属从其盐溶液中置换出来。我们把钠投入硫酸铜溶液中,会如何反应呢? 提示:将Na投入CuSO4溶液中,第一步为2Na+2H2O 2NaOH+H2↑;第二步为2NaOH+CuSO4 Cu(OH)2↓+Na2SO4;合并为2Na+CuSO4+2H2O Cu(OH)2↓+Na2SO4+H2↑。
钠与酸、盐溶液的反应(1)钠与酸反应钠与酸反应,实质上是钠与酸电离出的H+反应,当金属与酸溶液反应时,由于溶液 中的H+主要来源于酸,因此钠先与酸反应,若钠过量,则继续与水反应。(2)钠与盐溶液反应钠与盐溶液反应时首先与水反应生成氢氧化钠和氢气,然后生成的氢氧化钠与盐 发生反应,即钠与盐溶液反应的顺序是先水后盐,若氢氧化钠与盐不反应,则只发 生第一步反应。
(2021河南南阳第一中学高一上第一次月考)下列关于钠的叙述正确的是 ( )A.钠单质与氯化亚铁溶液反应生成氯化钠和铁单质
B.钠与水反应的现象说明钠的熔点低,且与水反应放出热量C.钠与酸溶液反应产生氢气,实质是钠与H2O反应D.将4.6 g金属钠投入95.4 g水中,所得溶液中溶质的质量分数为8%解析 钠单质与氯化亚铁溶液反应时,钠先与水反应生成氢氧化钠和氢气,然后 氢氧化钠和氯化亚铁反应生成氢氧化亚铁和氯化钠,不能置换出铁,A错误;钠与 水反应放出大量热,由于钠的熔点低,所以钠会熔化为小球,B正确;钠与酸溶液反 应的实质是钠与H+反应,C错误;4.6 g金属钠投入95.4 g水中,所得氢氧化钠的质量 为8 g,但反应放出氢气,则溶液的质量小于100 g,所以溶液中溶质的质量分数大于 8%,D错误。
过氧化钠(Na2O2)能与二氧化碳、水反应生成氧气,故可作为呼吸面具中的供氧 剂,潜水艇出现紧急情况时,也可使用过氧化钠来供氧。
问题1.Na2O与Na2O2都是碱性氧化物,你同意这种观点吗?提示:不同意。Na2O2不是碱性氧化物,碱性氧化物指的是与酸反应只生成盐和水 的氧化物。 2.CO2、H2O均可与Na2O2反应,相应的化学方程式分别是什么?提示:2Na2O2+2CO2 2Na2CO3+O2;2Na2O2+2H2O 4NaOH+O2↑。 L CO2和水蒸气的混合气体与足量的Na2O2反应,能得到相同条件下气体的 体积是多少?提示:根据CO2与Na2O2、H2O与Na2O2反应的化学方程式可知,2.24 L CO2和水蒸气 的混合气体与足量Na2O2反应,得到相同条件下1.12 L O2。
Na2O2与H2O、CO2反应的四大关系(1)CO2或H2O与O2的分子数目关系
无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O 与放出O2的分子数目之比均为2∶1。(2)固体质量的关系相当于固体(Na2O2)只吸收了CO2中的“CO”、H2O中的“H2”,可以看作发生相 应的反应Na2O2+CO Na2CO3,Na2O2+H2 2NaOH(实际上该反应不能发生)。(3)电子转移关系无论是与CO2还是与H2O反应,CO2与H2O均既不是氧化剂也不是还原剂,反应的实 质都是Na2O2自身发生的氧化还原反应,所以有1个O2分子生成时,转移2个电子。(4)先后顺序关系一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应,可视作Na2O2先与CO2反 应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。
(2021河南郑州巩义第四高级中学高一上第一次段测)下列关于Na2O与Na2O2的说 法中,错误的是( )A.两者颜色不同B.均可与H2O、CO2反应C.Na2O能被氧化成Na2O2D.它们的固体溶于水滴加酚酞溶液后,现象相同解析 过氧化钠与水反应生成氢氧化钠,过氧化钠还具有强氧化性,所以溶于水 滴加酚酞溶液后溶液先变红后褪色,D错误。
根据如图装置,向烧杯中加入一定量0.01 ml/L Ba(OH)2溶液,滴加几滴酚酞溶液,在酸式滴定管中加入0.2 ml/L H2SO4溶液,开启电源开关按钮,向烧杯中逐滴滴加H2SO4溶液,搅拌。灯泡由亮逐渐熄灭且烧杯中溶液的红色逐渐褪去,说明溶液中自由移动的离子逐渐减少到几乎没有;后来灯泡逐渐变亮,说明溶液中又产生了 自由移动的离子,这些现象都说明有离子参加了反应。
问题1.溶液中的红色逐渐褪去的原因是什么?提示:溶液中的红色逐渐褪去,是因为溶液中的OH-与H+反应,溶液碱性减弱。 2.BaCl2溶液能与Na2SO4溶液反应而KCl溶液却不能,试分析原因。提示:BaCl2溶液能与Na2SO4溶液反应生成BaSO4沉淀,而KCl溶液与Na2SO4溶液不 能生成沉淀、气体或弱电解质,二者不反应。3.弱电解质在离子反应中都写成化学式形式吗?强电解质在离子反应中都写成离 子形式吗?提示:弱电解质在离子反应中都写成化学式形式;强电解质在离子反应中可能写 成化学式形式也可能写成离子形式,如难溶盐属于强电解质,但要写成化学式形 式。
离子方程式的正误判断——“七看”(1)看反应是否符合客观事实。(2)看化学式拆写是否正确。(3)看符号使用是否正确。要注意“ ”“ ”“↓”“↑”等的正确使用。(4)看是否遵循质量守恒定律,电荷是否守恒。(5)看是否漏掉参加反应的离子。(6)看反应物或生成物的配比是否正确。(7)看是否符合题设条件。如过量、少量、等物质的量、适量、任意量以及滴加 顺序等对反应产物的影响。
苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物教课内容ppt课件: 这是一份苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物教课内容ppt课件,共29页。
高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物一等奖ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物一等奖ppt课件,共36页。PPT课件主要包含了学习目标,全电离,不能完,自由离子,难电离,挥发性,离子符号,离子共存问题等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物教课课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物教课课件ppt,共34页。PPT课件主要包含了课堂小结等内容,欢迎下载使用。













