




化学人教版 (2019)第二章 海水中的重要元素——钠和氯综合与测试多媒体教学ppt课件
展开
这是一份化学人教版 (2019)第二章 海水中的重要元素——钠和氯综合与测试多媒体教学ppt课件,共31页。PPT课件主要包含了内容索引,知识网络,重难突破,物质的量浓度等内容,欢迎下载使用。
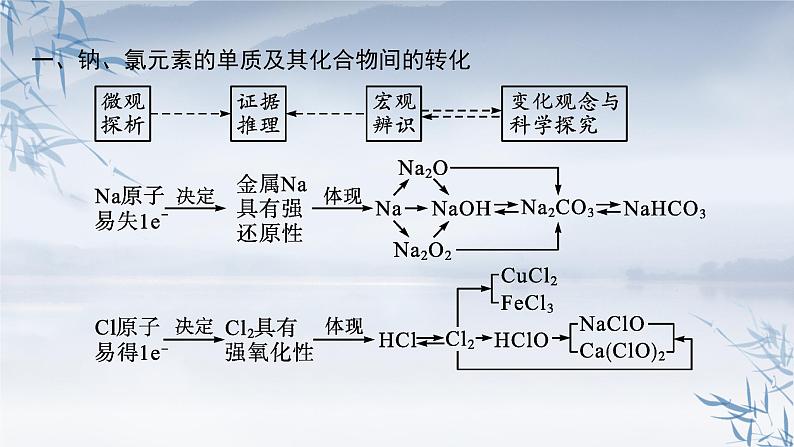
一、钠、氯元素的单质及其化合物间的转化
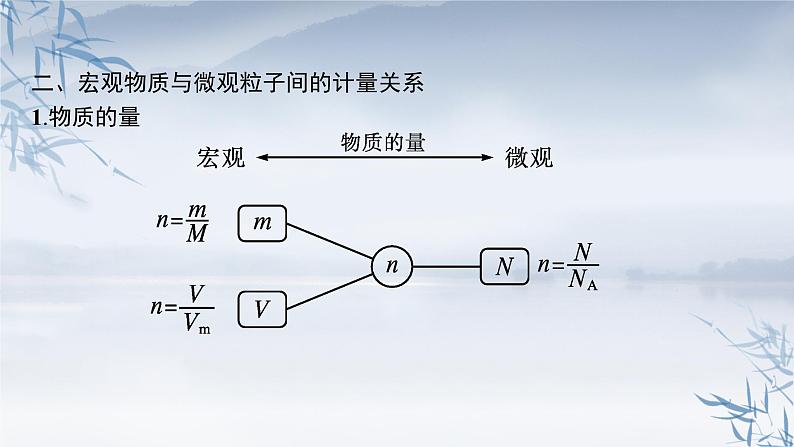
二、宏观物质与微观粒子间的计量关系1.物质的量
典例1有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:①W X+H2O+CO2↑②Z+CO2→X+O2③Z+H2O→Y+O2↑④X+Ca(OH)2→Y+CaCO3↓试回答下列问题:(1)W、X、Y、Z的化学式分别是W 、X 、Y 、Z 。 (2)以上4个化学反应,属于氧化还原反应的是 (填反应序号),反应中氧化剂是 (写化学式),还原剂是 (写化学式)。
(3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:离子方程式: 。 化学方程式: 。
答案 (1)NaHCO3 Na2CO3 NaOH Na2O2(2)②③ Na2O2 Na2O2
钠及其化合物之间的转化关系如下:
对点训练1下列说法正确的是( )①Na2O2投入到紫色石蕊溶液中,溶液先变蓝,后褪色;②Na2O和Na2O2投入到水中都能生成NaOH;③质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的量相等;④取a g Na2CO3和NaHCO3混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g,能测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数;⑤区别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液;⑥NaHCO3固体可以用来制作干粉灭火剂,金属钠起火可以用它来灭火;⑦NaHCO3粉末中混有Na2CO3,可配制成溶液通入过量的CO2,再低温结晶得以提纯。A.②③④B.②⑤⑦ C.①②⑦D.③④⑥
答案 C解析 ①Na2O2与水反应产生NaOH使溶液显碱性,所以溶液先变为蓝色,又由于过氧化钠具有强氧化性而具有漂白性,所以溶液又由蓝色变为无色,①正确;②Na2O与水反应产生NaOH,Na2O2与水反应产生NaOH和O2,因此二者都能与水反应生成NaOH,②正确;③根据C元素守恒,质量相等的NaHCO3与Na2CO3中含有的C元素质量不相等,所以二者分别与相同浓度盐酸完全反应时,产生CO2的物质的量不相等,③错误;④碱石灰既能吸收CO2,也能吸收水分,因此不能根据碱石灰增重质量测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数,④错误;⑤Ca(OH)2与NaHCO3或Na2CO3溶液都能反应产生CaCO3白色沉淀,故不能用Ca(OH)2溶液鉴别二者,⑤错误;
⑥NaHCO3固体受热分解产生CO2,可用于灭火,金属钠起火时产生的Na2O2与CO2及H2O发生反应产生氧气,因此不能用干粉灭火剂灭火,⑥错误;⑦由于Na2CO3在溶液中会与CO2、H2O发生反应,产生NaHCO3,所以NaHCO3粉末中混有Na2CO3,可配制成溶液通入过量的CO2,反应产生NaHCO3,然后再低温结晶得以提纯,⑦正确;综上所述可知正确说法是①②⑦,故合理选项是C。
典例2如图所涉及的物质均为中学化学中的常见物质,其中C为气态单质,D为黄绿色气体,E为固态单质,它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的化学式:F ,H 。 (2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。 (3)若反应①是在加热条件下进行的,则A是 (填化学式,下同),若反应①是在常温条件下进行的,则A是 。 (4)写出B与MnO2共热获得D的化学方程式: 。
答案 (1)Fe3O4 FeCl3(2)催化 氧化 (3)KClO3 H2O2(4)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O解析 黄绿色气体D是Cl2,然后根据框图转化关系可推知,B为盐酸,C为O2,E为Fe,A可能为H2O2或KClO3,F为Fe3O4,G为FeCl2,H为FeCl3。当反应①在加热条件下进行时,A为KClO3;当①在常温条件下进行时,A为H2O2,且在反应中MnO2皆做催化剂;而在反应②中MnO2为氧化剂,将HCl氧化为Cl2。
氯元素是中学化学中非金属元素的典型代表,试题往往以Cl2、氯水(氧化性为主)的性质和发生的化学反应及其化合物在生活中的应用为背景,以选择题、物质推断题的形式进行考查。
对点训练2洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为 。 (2)漂白粉的有效成分是 (填化学式)。 (3)漂白粉溶于水后,受空气中CO2的作用,即产生有漂白、杀菌作用的次氯酸,发生化学反应的离子方程式为 。 (4)反应(1)和反应(3)中,属于氧化还原反应的是反应 (填编号)。 (5)瓶装漂白粉久置于空气中呈稀粥状而失效。试用化学方程式表示漂白粉在空气中易失效的原因: 。
(6)已知浓盐酸和次氯酸钙能发生反应Ca(ClO)2+4HCl(浓) === CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是 (填字母)。 ①CO2 ②HCl ③H2O ④H2A.①②③B.②③④C.只有②③D.只有①④
典例3(1)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·ml-1。若阿伏加德罗常数值用NA表示,则:①该气体的物质的量为 ml。 ②该气体所含原子总数为 个。 ③该气体在标准状况下的体积为 L。 (2)利用“化学计量在实验中的应用”的相关知识进行填空。①含有6.02×1023个氧原子的H2SO4的物质的量是 ml。 ②与标准状况下V L CO2所含氧原子数目相同的水的质量是 (用分式表示)g。 ③在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是 。
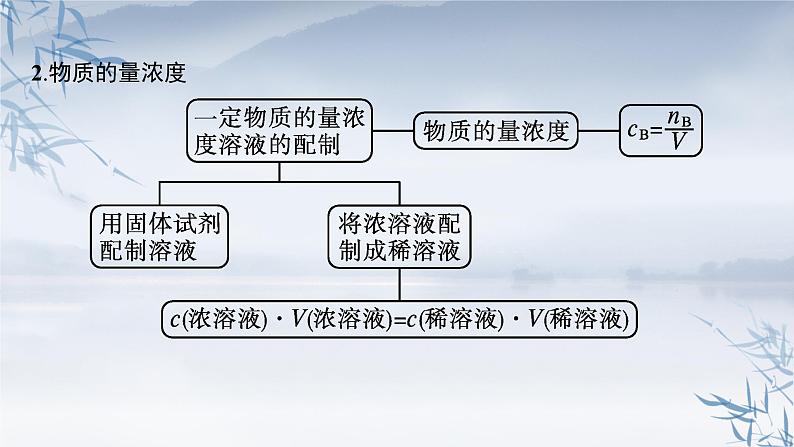
(3)含CuSO4和H2SO4的混合溶液200 mL,其中CuSO4的物质的量浓度为 1 ml·L-1,H2SO4的物质的量浓度为0.5 ml·L-1,若用此溶液配成0.2 ml·L-1的CuSO4和2 ml·L-1 H2SO4的混合溶液,则所得溶液的体积是 mL;需加入密度为1.84 g·cm-3、溶质质量分数为98%的浓硫酸 mL。
③在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,设该化合物的化学式是Z,由气体的体积之比=物质的量之比,则有X2+3Y2 === 2Z,由原子守恒可知,Z为XY3。(3)原混合溶液中含CuSO4的物质的量浓度为1 ml·L-1,现需要CuSO4溶液的浓度为0.2 ml·L-1,因此要进行稀释,设稀释后所得溶液的体积为V,则有:1 ml·L-1×0.2 L=0.2 ml·L-1×V,解得V=1 L=1 000 mL。因要求所配溶液中H2SO4的浓度为2 ml·L-1,所以需加入H2SO4的物质的量为2 ml·L-1×1 L-0.2 L×0.5 ml·L-1=1.9 ml,此部分硫酸由密度为1.84 g·cm-3、溶质质量分数为98%的浓硫酸提供,设所需此浓硫酸的体积为y,此浓硫酸的物质的量浓度为 ml·L-1=18.4 ml·L-1,则有18.4 ml·L-1×y=1.9 ml,得y≈0.103 3 L=103.3 mL。
物质的量与其他化学计量之间的联系
注意事项(1)若题目中给出物质的体积:①看是否处于标准状况。若不是标准状况,则1 ml气体体积一般不为22.4 L。②看该物质在标准状况下是否为气体。若不是气体,则无法用气体摩尔体积求算该物质的物质的量或分子数目,如标准状况下的H2O;若是气体,则可用 ,求算出该物质的n或N,这与是混合气体还是单一气体无关。
(2)若题目中给出气体物质的质量或物质的量,该物质的粒子数目与外界条件(是否处于标准状况下)无关。(3)若题目要求计算物质分子中的原子个数,需注意物质的组成。例如稀有气体分子为单原子分子、臭氧(O3)分子为三原子分子、甲烷(CH4)分子为五原子分子等。(4)若题目要求计算分子、原子、离子中的质子或电子数目,需正确运用原子中质子数等于电子数,离子中质子数、电子数、电荷数之间的关系进行求解。
对点训练3空气是指地球大气层中的混合气体,因此空气属于混合物,它主要由氮气、氧气、稀有气体(氦、氖、氩、氪、氙、氡)、二氧化碳以及其他物质(如水蒸气、杂质等)组合而成。其中氮气的体积分数约为78%,氧气的体积分数约为21%。若NA表示阿伏加德罗常数的值,下列有关空气各成分的说法中,正确的是( )A.20 g氖气所含有的分子数约为3.01×1023B.在0 ℃、101 kPa时,22.4 L氮气中含有NA个氮原子C.在25 ℃、1.01×105 Pa时,44 g CO2中含有的原子数为3NAD.NA个水分子和0.5 ml氧气的质量比为9∶16
相关课件
这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料集体备课ppt课件,共22页。PPT课件主要包含了知识网络系统构建,专题归纳素养整合,2三角转化,答案A等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修3第五章 合成高分子本章综合与测试评课ppt课件,共1页。
这是一份高中化学人教版 (2019)必修 第一册第一章 物质及其变化综合与测试说课课件ppt,共35页。PPT课件主要包含了内容索引,知识网络,重难突破,化学反应的分类,物质的转化,氧化还原反应,答案A,答案D,守恒法思维模型等内容,欢迎下载使用。










