






高中化学人教版 (2019)必修 第一册第一节 铁及其化合物课文配套ppt课件
展开
这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物课文配套ppt课件,共34页。PPT课件主要包含了+2价和+3价,硅和铝,铁矿石,银白色粉末为黑色,FeCl2+H2↑,逐渐溶解,气泡或气体,FeSO4+Cu,Fe3O4,棕色烟等内容,欢迎下载使用。
【学习目标】1.了解铁元素在自然界中的存在形态、与人体健康的关系,体会化学对人类生活的重要意义;从我国古代应用铁的化学史感受中华民族在科技发展进程中的贡献,增强文化自信。2.能用氧化还原反应原理进一步认识铁的化学性质,基于实验事实写出铁与水蒸气反应的化学方程式,并用于解释生产中简单的化学问题,培养安全意识。3.通过实验探究铁的氢氧化物、铁盐和亚铁盐的化学性质,并能用化学方程式或离子方程式正确表示。体会实验对认识和研究物质性质的重要作用,形成证据意识。
4.通过学习铁及其化合物,学会从物质类别和元素价态的视角认识具有变价元素物质间的转化关系,并建立认识模型,丰富研究物质的思路和方法。5.结合应用实例,将铁及其化合物性质的知识运用于解决生产、生活中简单的化学问题,强化性质决定用途的观念。
第1课时 铁的单质 铁的氧化物
学习任务一 铁的单质【课前自主预习】一、铁的存在及冶炼1.铁在自然界中可以 形态存在于陨铁中,但主要以 化合物的形态存在于矿石中。铁元素在地壳中的含量,仅次于 ,居第四位。
2.工业炼铁的原理是用 的方法把铁从 中提炼出来,炼铁高炉中常用焦炭、铁矿石、空气等为原料炼铁。以赤铁矿(Fe2O3)为原料,利用焦炭在炉内发生反应生成CO2和CO,再由CO将铁还原出来。炼铁的主要化学方程式分别为 、 、 。
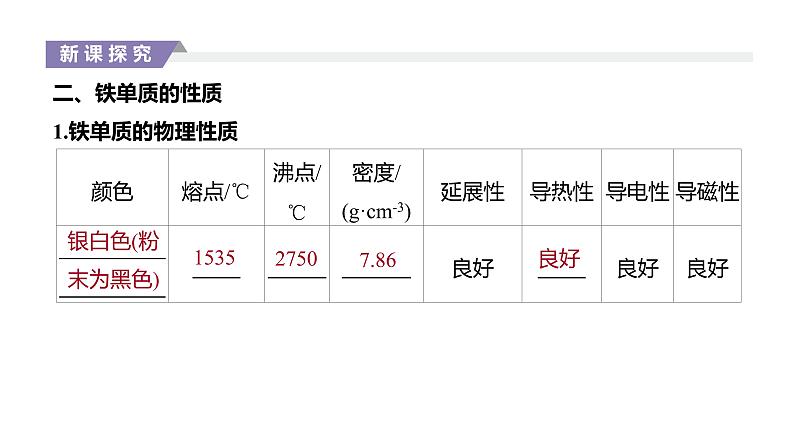
二、铁单质的性质1.铁单质的物理性质
2.铁单质的化学性质(1)与盐酸反应Fe+2HCl= ,固体 ,产生 ,溶液逐渐变为浅绿色,离子方程式为 。 (2)与CuSO4溶液反应Fe+CuSO4= ,固体表面变 ,离子方程式为 。
Fe+2H+=Fe2++H2↑
Fe+Cu2+=Fe2++Cu
(3)与非金属单质反应Fe+
(4)铁与水蒸气的反应[实验探究] 铁与水蒸气的反应
提供水蒸气,使之与还原铁粉在高温下发生反应
产生气泡,便于通过点燃验证产物中的气体
[答案]提示:高温下铁与水反应会产生氢气,氢气属于可燃性气体,易引发危险。
问题一:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分干燥处理,不得留有水,为什么?
问题二:结合已学过知识对比钠和铁与水反应的条件和程度有何差异?金属与水反应的本质是什么?
[答案]提示:钠与冷水剧烈反应;铁常温下和加热条件下与液态水不反应,高温水蒸气才能与铁粉反应。金属与水反应的本质是金属与水电离产生的H+反应生成氢气。
【核心知识讲解】一、从氧化还原角度认识铁的性质:
Fe作为还原剂:1.与氧化性较弱的氧化剂,如盐酸、硫酸铜、某些非金属单质反应生成Fe2+。2.与氧化性较强的氧化剂,如氯气(注意:不论Fe是否过量均生成FeCl3)反应生成Fe3+。3.与液态水不反应,与水蒸气在高温下反应生成Fe3O4和H2。
二、金属与水反应的一般规律 按照金属活动顺序表,因金属的活泼性不同,与水反应的条件和剧烈程度有差异,可归纳如下。1.活泼金属如K、Na等可与冷水迅速剧烈反应(放热反应),生成可溶性碱和H2。2Na+2H2O=2NaOH+H2↑2.Mg与冷水反应缓慢,但在加热条件下(或用沸水),Mg与水的反应加快。Mg+2H2O Mg(OH)2+H2↑
3.Fe、Zn等可以和水蒸气反应生成金属氧化物和H2。3Fe+4H2O(g) Fe3O4+4H24.Cu、Hg、Ag、Pt、Au不与水反应。
例1 下列有关铁的说法中正确的是( )A.铁与水蒸气在高温下的反应产物为Fe2O3和H2B.铁能与盐酸反应生成氯化铁和氢气C.Fe与少量Cl2反应生成FeCl2D.铜粉中混有少量铁粉,可加入足量盐酸充分反应后过滤除去
例2 某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙。已知B中放入的是铁粉与石棉绒的混合物,C放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:(1)如何检查乙装置的气密性? , , ,, 。(2)乙装置中湿沙子的作用是 。
向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好(其他合理答案也可)
(3)B处发生反应的化学方程式为 。 (4)该同学认为在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是 。 (5)对比甲、乙两装置的B和K,B的优点是 , , 。
干燥氢气,降低H2中水蒸气的含量
使用石棉绒,增大水蒸气与铁粉的接触面积,使反应充分进行
[易错警示] 铁的性质中的易错点(1)常温下,Fe在冷的浓硫酸中发生钝化,因此常温下能用铁制容器盛装浓硫酸。(2)①Fe在O2中燃烧以及与H2O(g)反应的产物都是Fe3O4而不是Fe2O3;②Fe在Cl2中燃烧,无论Cl2过量还是不足均生成FeCl3;③Fe与S反应时只能生成FeS。
学习任务二 铁的氧化物【课前自主预习】一、物理性质
二、化学性质及用途1.FeO不稳定,在空气中受热易被氧化成 。 2.FeO和Fe2O3属于碱性氧化物,与非氧化性强酸反应的离子方程式分别为 , 。 3.用途:Fe2O3常用作红色油漆和涂料,赤铁矿(主要成分是 )是炼铁原料。
FeO+2H+=Fe2++H2O
Fe2O3+6H+=2Fe3++3H2O
【核心知识讲解】从氧化还原角度分析铁的氧化物的性质
1.FeO中铁的化合价为+2价,处于铁的中间价态,故既有氧化性,又有还原性。2.Fe2O3中铁的化合价为+3价,铁的化合价处于铁的最高价,只有氧化性。3.Fe3O4中的铁有+2、+3价,故该化合物既有氧化性,又有还原性。
[注意] Fe3O4中铁有+2、+3价两种价态,可写为FeO·Fe2O3,Fe3O4属于复杂的氧化物,但是不能认为是Fe2O3和FeO组成的混合物。写Fe3O4与盐酸反应方程式时可看作Fe2O3、FeO分别与盐酸反应,然后再把两个反应叠加。
[解析] FeO不稳定,在空气中加热迅速被氧化成Fe3O4。
例4 金属单质A可发生以下反应。试推断: (1)A、B、C、D、E分别是(写化学式,B写主要成分)A 、B 、C 、D 、E 。 (2)写出反应③和⑤的离子方程式:③ ; ⑤ 。
Fe+Cu2+=Fe2++Cu
1.判断正误(正确的打“√”,错误的打“×”)。(1)铁的化学性质活泼,所以铁在自然界中全部以化合态存在。 ( )(2)铁粉作食品袋内的脱氧剂时起氧化作用。 ( )(3)铁与稀硫酸反应的离子方程式:2Fe+6H+=2Fe3++3H2↑。 ( )(4)Fe2O3俗称铁红,常用作红色油漆和涂料。 ( )(5)FeO和Fe2O3都是碱性氧化物,都能与酸发生反应。 ( )(6)3 ml单质Fe完全转变为Fe3O4,失去8 ml电子。 ( )
2.下列说法中正确的是( )A.铁在干燥的空气中剧烈燃烧,火星四射,生成黑色的Fe3O4B.铁跟盐酸反应生成氯化铁和氢气C.铁丝浸入硫酸铜溶液中片刻,取出,表面出现红色的铁锈D.赤铁矿的主要成分是Fe2O3
[解析] 由于空气中的氧气含量较少,所以铁丝在干燥的空气中不能剧烈燃烧,只有在纯氧中才能剧烈燃烧,A项错误;铁跟盐酸发生置换反应,放出氢气,同时生成氯化亚铁(FeCl2),而不是氯化铁(FeCl3) ,B项错误;铁丝跟硫酸铜反应置换出铜,铁丝表面的红色物质是铜,不是铁锈,C项错误;D项正确。
3.铁与水蒸气反应的实验装置如图,下列说法正确的是( )A.实验时,试管口应高于试管底B.加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声C.反应的化学方程式为2Fe+3H2O(g) Fe2O3+3H2D.试管中发生化合反应
4.以下有关铁的氧化物的叙述中正确的是( )A.常见的铁的氧化物FeO、Fe2O3、Fe3O4都是黑色B.铁的氧化物中Fe2O3、Fe3O4都有导磁性C.作为炼铁原料之一的赤铁矿的主要成分是Fe2O3D.铁的氧化物Fe2O3、Fe3O4都只有氧化性
[解析] FeO和Fe3O4是黑色的,而赤铁矿的主要成分是红棕色的Fe2O3,A错误而C正确;常见的三种铁的氧化物中,只有Fe3O4有导磁性,B错误;Fe3O4中铁的化合价为+2价和+3价,既有氧化性又有还原性,D错误。
(1)A装置的作用是 , ,B中反应的化学方程式为 。
5.某化学兴趣小组利用如图装置进行“铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
产生水蒸气
(2)D的作用是 。 (3)E中的现象是 , 。 (4)A、B两个装置中应先点燃 ,处的酒精灯,点燃E处酒精灯之前应进行的操作是 。
黑色固体变为红色,右端管壁有水珠生成
收集H2,并检验其纯度
1.下列关于铁的叙述正确的是( )①铁能被磁铁吸引 ②人体的血红蛋白中含有铁元素 ③铁能与氧气反应,但不能与水蒸气反应 A.① B.③ C.①② D.①③
相关课件
这是一份人教版 (2019)必修 第一册第一节 铁及其化合物课堂教学ppt课件,共41页。PPT课件主要包含了第一节铁及其化合物,新课情境呈现,课前素能奠基,课堂素能探究,知识点一,典例1,知识点二,典例2,补铁药没有变质,补铁药完全变质等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物备课ppt课件,共46页。PPT课件主要包含了第一节铁及其化合物,新课情境呈现,课前素能奠基,氢氧化铁胶体,Fe2O3,延展性,导热性,磁性氧化铁,红褐色,难溶于水等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第一节 铁及其化合物课前预习ppt课件,共60页。PPT课件主要包含了课前自主学习,无明显现象,氧化性,还原性,氢氧化铁胶体,课堂合作探究,KSCN,探究总结,用NaOH溶液,检验方法等内容,欢迎下载使用。










