






人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律备课课件ppt
展开1.元素周期表中,同一周期从左到右,金属性逐渐减弱,非金属性逐渐增强;同一主族自上而下,金属性逐渐增强,非金属性逐渐减弱。2.元素周期表中,第三周期中金属与非金属分界处的元素是铝(Al)和硅(Si)。3.常用作半导体材料的硅,在元素周期表中的位置是第三周期第ⅣA族。4、元素周期律的内容:元素的性质随着原子序数的递增而呈周期性的变化。5、元素周期律的实质:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
元素周期表中的递变规律
同周期主族元素: 从左到右原子半径依次减小 (除稀有气体)
B. 同主族元素: 从上到下原子半径逐渐变大
主族元素原子半径的规律
【思考与讨论】类比原子半径的影响因素,思考以下问题。
建模:原子半径的影响因素为电子层数和核电荷数
1、当电子层数及核电荷数均不同时,电子层数越多的,半径越大;如Na<K(层不同,层多,径大)2、当电子层数相同时,核电荷数越大的,半径越小;如Na>Mg;Na+>Mg2+(层相同,核多,径小)3、阴离子半径大于对应的原子半径;如Cl<Cl-4、阳离子半径小于对应的原子半径;如Na> Na+
5、电子排布相同的离子,离子半径随着核电荷数的递增而减小。O2- > F- > Na+ > Mg2+ > Al3+
用模:微粒半径的影响因素为电子层数、核电荷数、核外电子数
2、元素化合价的变化规律:观察下表,归纳总结一下主族元素的最高正价和最低负价与元素原子的核外电子排布以及主族序数之间的关系。
(1)最高正价 = 最外层电子数=主族族序数
(氧,氟例外,氟无正价,氧无最高正价)
(2)最低负价=使原子达到8电子稳定结构所需得到的电子数
(3)最高正价+ |最低负价|=8(H的最低负价为-1)
元素周期表中元素的金属性和非金属性变化的规律是什么?
同周期元素由左向右金属性减弱,非金属性增强;同主族元素由上向下金属性增强非金属性减弱
金属性增强非金属性减弱
金属性减弱非金属性增强
短周期主族元素金属性最强的元素是Na;非金属性最强的元素F。
【思考与交流】根据之前的学习,总结比较元素的非金属性和金属性强弱的方法。
证明金属性强弱的方法有:1、单质与水(或酸)反应生成氢气的难易(金属性越强反应越容易)2、最高价氧化物的水化物——氢氧化物的碱性强弱(金属性越强氢氧化物的碱性越强)
证明非金属性强弱的方法有:1、单质与氢气反应生成气态氢化物的难易(非金属性越强反应越容易)2、最高价氧化物的水化物的酸性强弱(非金属性越强酸性越强)3、气态氢化物的稳定性(非金属性越强气态氢化物越稳定)
短周期主族元素中最高价氧化物的水化物酸性最强的是 。碱性最强的是 。气态氢化物稳定性最强的是 。
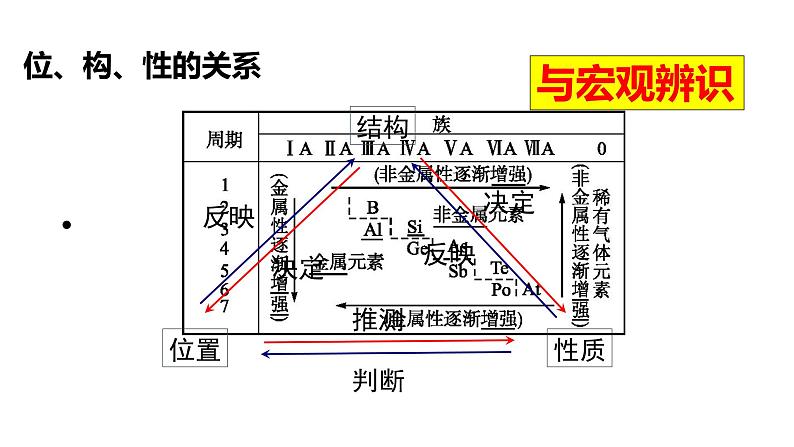
元素周期表和元素周期律的应用
根据元素周期表和元素周期律,互相交流讨论,填写下表:
位置、结构、性质之间的相互推断
①进行“位置,结构,性质”的推导
④寻找催化剂,耐高温、耐腐蚀的合金
【反馈练习1】X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构.下列说法正确的是( )A. 原子最外层电子数:X>Y>ZB. 对应气态氢化物的稳定性:X>ZC. 离子半径:X2->Y+>Z-D. 原子序数:X>Y>Z
X、Y、Z均是短周期元素,X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素。
【反馈练习2】某主族元素R的最高正化合价与负化合价的代数和为4,下列有关叙述正确的是 A、R一定是第四周期元素 B、R的气态氢化物分子式为H2R C、R的气态氢化物比同周期其他元素的气态氢化物稳定 D、R的气态氢化物的水溶液显碱性
非金属元素的最高正价和最低负价的绝对值之和等于8,R的最高正化合价与负化合价的代数和为4,所以R的最高正价为+6,最低负价为-2,可以推断出R在第ⅥA族
【练习3】电子层数相同的三种元素X、Y、Z,它们最高氧化物对应的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4。下列判断中不正确的是( )A、原子序数:X
电子层数相同说明三种元素在同一周期,根据其最高正价判断X、Y、Z分别在ⅦA族、ⅥA族、ⅤA族,所以由左向右的顺序为Z Y X。
【反馈练习4】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )A. Y的最高价氧化物对应水化物的酸性比X的弱B. Z位于元素周期表中第二周期,第ⅥA族C. X的气态氢化物的稳定性比Z的弱D. M的原子半径比Y的原子半径大
由四种短周期元素在元素周期表中的位置,可知Y、Z处于第二周期,M、X处于第三周期,其中只有M一种为金属元素,则M为Al,可推知X为Si,Y为N,Z为O。
人教版 (2019)必修 第一册第一节 铁及其化合物图片ppt课件: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物图片ppt课件,共39页。PPT课件主要包含了由1到8,由大到小,+1→0,+1→+5,-4→-1→0,+1→+7,+1到+7,-4到-1,浮在水面,熔成小球等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律教学演示课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律教学演示课件ppt,共50页。PPT课件主要包含了课前自主学习,金属性,非金属性,最外层电子数,族序数,课堂合作探究,元素周期表元素周期律,元素分区,元素化合价,外在表现等内容,欢迎下载使用。
化学必修 第一册第二节 元素周期律授课ppt课件: 这是一份化学必修 第一册第二节 元素周期律授课ppt课件,共39页。PPT课件主要包含了必备知识·自主学习,非金属,金属性,非金属性,FrOH,HClO4,主族序数,最外层电子数,原子结构和性质,关键能力·合作学习等内容,欢迎下载使用。













