






2020-2021学年第三节 氧化还原反应课堂教学课件ppt
展开Na、Mg、Al与冷水的反应
结合价态分析在氧化还原反应中哪些物质有氧化性或还原性?
氧化剂和氧化产物中的元素化合价较高,具有氧化性
还原剂和还原产物中的元素化合价较低,具有还原性
1、默写金属活动性顺序表 2、西汉刘安的《淮南万毕术》记载古代的湿法冶铜方法“曾青得铁则化为铜”,此反应化学方程式为:Fe+CuSO4=FeSO4+Cu。下列相关说法错误的是( ) A. CuSO4是氧化剂 B. Fe体现还原性 C. Cu是氧化产物 D.上述反应中转移2e-
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
氧化还原反应强弱规律与应用
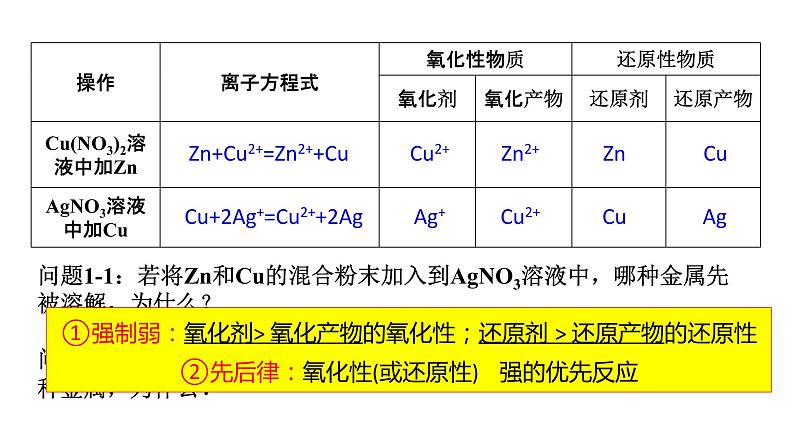
问题1-1:若将Zn和Cu的混合粉末加入到AgNO3溶液中,哪种金属先被溶解,为什么? 问题1—2:如果将Zn加入到Cu(NO3)2和AgNO3溶液中,最先置换出哪种金属,为什么?
①强制弱:氧化剂> 氧化产物的氧化性;还原剂 > 还原产物的还原性②先后律:氧化性(或还原性) 强的优先反应
Zn+Cu2+=Zn2++Cu
Cu+2Ag+=Cu2++2Ag
【思考】已知:Cl2+2Br-==2Cl-+Br2、Br2+2I-==2Br-+I2 ,比较微粒性质,由强到弱排列顺序:(1)Cl2、Br2、I2的氧化性:_______________(2)Cl-、Br-、I-的还原性:______________
问题1-3:已知:Fe3++2I-==2Fe2++I2 、2Fe2++Br2==2Fe3++2Br- 往FeBr2溶液中通入少量Cl2,哪种离子先被氧化?若改为FeI2呢?
K+ < ... < Fe2+ ...< H+ < Cu2+ < Hg2+ < Ag+ …
K > ... > Fe >... > H2 > Cu > Hg > Ag > ...
S < I2 < Br2 < Cl2 < F2
S2- > I- > Br- > Cl- > F-
【应用】工业生产应用了物质的哪些性质?1.刻蚀铜电路板的原理为:2Fe3++Cu=2Fe2++Cu2+ 比较氧化性:Fe3+ Cu2+2.工业海带提碘流程如下图,“氧化”操作发生反应:Cl2+2I-=2Cl-+I2 , 比较:①氧化性:Cl2 __ I2; ②还原性:Cl- I-
氧化还原反应价态规律与应用
【思考1】结合元素化合价,判断物质的氧化性或还原性
【模型应用】价态与氧化还原性关系
问题2-1:S2-与SO32-能否发生氧化还原反应,试推测反应产物? 【实验验证】提示:硫黄(S)是淡黄色晶体,难溶于水。
问题2-2:能用浓硫酸干燥SO2气体吗?为什么?
2S2-+SO32-+2H+ =S↓+2H2O
【归中反应】高价 + 低价 → 中间价 (只靠拢不交叉)
【应用】为了消除碘(元素)缺乏病,即地方性甲状腺肿大和克汀病,规定在食盐中须加入适量的碘酸钾。如何检验食盐中是否加碘?【设计实验】提示:碘元素常见价态有-1、0、+1、+3、+5价
5I-+IO3-+6H+ =3I2+3H2O
【思考2】漂白粉的主要成分含Ca(ClO)2、CaCl2等,因其价格低廉、杀菌力强、消毒效果好,广泛应用于各种设施及物品的杀菌消毒,此外也常用于油脂、淀粉、果皮等食物的漂白。其制备原理为:2Ca(OH)₂+2Cl₂=Ca(ClO)₂+CaCl₂+2H2O,试分析该反应中的氧化剂、还原剂及其产物,观察化合价的变化有什么特点?
【歧化反应】中间价 → 高价 + 低价
氧化还原反应中的守恒律与应用
问题3-1: 生活中常见新闻报道,某居民误将“84”消毒液(有效成分NaClO)与洁厕灵(主要成分盐酸)混用,导致Cl2中毒,试分析原因?书写涉及反应的化学方程式。
NaClO + 2HCl == NaCl + Cl2↑+ H2O
评测反馈:配平下列两个化学方程式:I、___Cl2+____KBr ==_____KCl+_____Br2;II:___KClO3+____HCl==___Cl2+___KCl+___H2O;①Cl2、KClO3、Br2氧化性由强到弱的顺序为___________________;②在反应II中,氧化剂与还原剂的个数之比为___________。
1 2 2 1
1 6 3 1 3
KClO3、Cl2、Br2
人教版 (2019)必修 第一册第三节 氧化还原反应评课课件ppt: 这是一份人教版 (2019)必修 第一册第三节 氧化还原反应评课课件ppt,共60页。PPT课件主要包含了课前自主学习,化合价降低,化合价升高,还原性,活泼非金属单质,Cu2+,的化合物,得电子,失电子,既有氧化性又有还原性等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教课内容ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教课内容ppt课件,共60页。PPT课件主要包含了氧化反应,Fe2O3,还原反应,化合价升降,共用电子对的偏移,复分解,点击右图进入等内容,欢迎下载使用。
人教版 (2019)第一章 物质及其变化第三节 氧化还原反应教学ppt课件: 这是一份人教版 (2019)第一章 物质及其变化第三节 氧化还原反应教学ppt课件,共44页。













