
所属成套资源:黑龙江省八校联考高二上学期各科试卷及答案
黑龙江省八校2021-2022学年高二上学期期中联合考试化学试题 含答案
展开
这是一份黑龙江省八校2021-2022学年高二上学期期中联合考试化学试题 含答案,共13页。试卷主要包含了下列化学用语书写正确的是,下列图示与对应的叙述相符的是,已知0,下列说法正确的是,3 kJ/ml,则含40等内容,欢迎下载使用。
黑龙江省2021-2022学年度上学期八校期中联合考试
高二化学试题
一.选择题(每题一个选项符合题意,1-10每题2分,11-20每题3分共50分)
1.下列各组关于强电解质、弱电解质、非电解质的分类,完全正确的是( )
选项
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
蔗糖
BaSO4
酒精
Cl2
2.下列化学用语书写正确的是( )
A.水溶液中NH4HSO4的电离方程式:NH4HSO4NH4++H++SO42-
B.水溶液中H2CO3的电离方程式:H2CO32H++CO32-
C. NaHCO3溶液水解的离子方程式:HCO+H2OCO+H3O+
D.AlCl3溶液水解的离子方程式:Al3++3H2OAl(OH)3+3H+
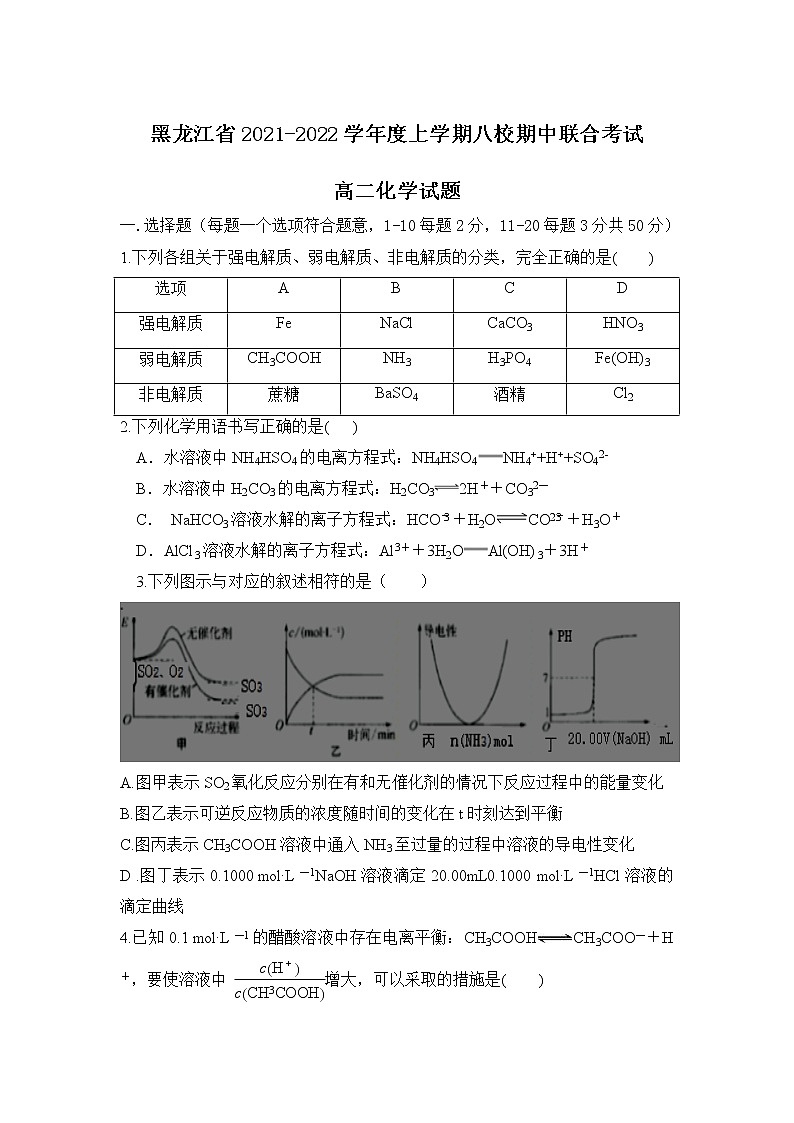
3.下列图示与对应的叙述相符的是( )
A.图甲表示SO2氧化反应分别在有和无催化剂的情况下反应过程中的能量变化
B.图乙表示可逆反应物质的浓度随时间的变化在t时刻达到平衡
C.图丙表示CH3COOH溶液中通入NH3至过量的过程中溶液的导电性变化
D .图丁表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1HCl溶液的滴定曲线
4.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,要使溶液中 增大,可以采取的措施是( )
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水 ⑤加少量醋酸钠固体
A.②④ B.②③⑤ C.③④⑤ D.①②
5.下列说法与盐类的水解有关的有几项( )
①氯化铵与氯化锌溶液可作焊接金属过程中的除锈剂
②用碳酸氢钠与硫酸铝两种溶液可作泡沫灭火剂
③配制硫酸亚铁溶液时需加入少量铁粉
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤比较氯化铵和硫化钠等盐溶液的酸碱性
⑥草木灰与铵态氮肥不能混合施用
⑦Na2SO3溶液蒸干后得到Na2SO4固体
A.4项 B.5项 C.6项 D.7项
6.下列说法正确的是( )
A.已知2CO2(g)= 2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1则CO(g)的燃烧热:ΔH =-283.0 kJ·mol-1,
B.已知NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ热量
C.已知2C(s)+2O2(g)= 2CO2(g) ΔH=a kJ·mol-1;2C(s)+O2(g)= 2CO(g) ΔH=b kJ·mol-1,则a>b
D.已知C(石墨,s)= C(金刚石,s) ΔH>0,则金刚石比石墨稳定
7.下列说法正确的是( )
A. PH试纸在使用之前应用蒸馏水润湿
B. 用广泛PH试纸测某盐酸的PH=2.3
C. 常温下反应2Na2SO3(s)+O2(g)= 2Na2SO4(s)能自发进行,则ΔH < 0
D. 增大压强(对于气体反应),活化分子百分数增大,故反应速率增大
8.在一个恒容密闭容器中发生如下反应:A(g) + 3B(g) C(g),反应过程中某一时刻测得A、B、C的浓度分别为0.8 mol·L-1、1.2 mol·L-1、0.6 mol·L-1,当反应达到最大限度时,可能出现的数据是( )
A. c(B) = 3 mol·L-1 B. c(A) = c(C) = 0.5 mol·L-1
C. c(A)= 0.6 mol·L-1 D. c(A)+ c(C) = 1.5 mol·L-1
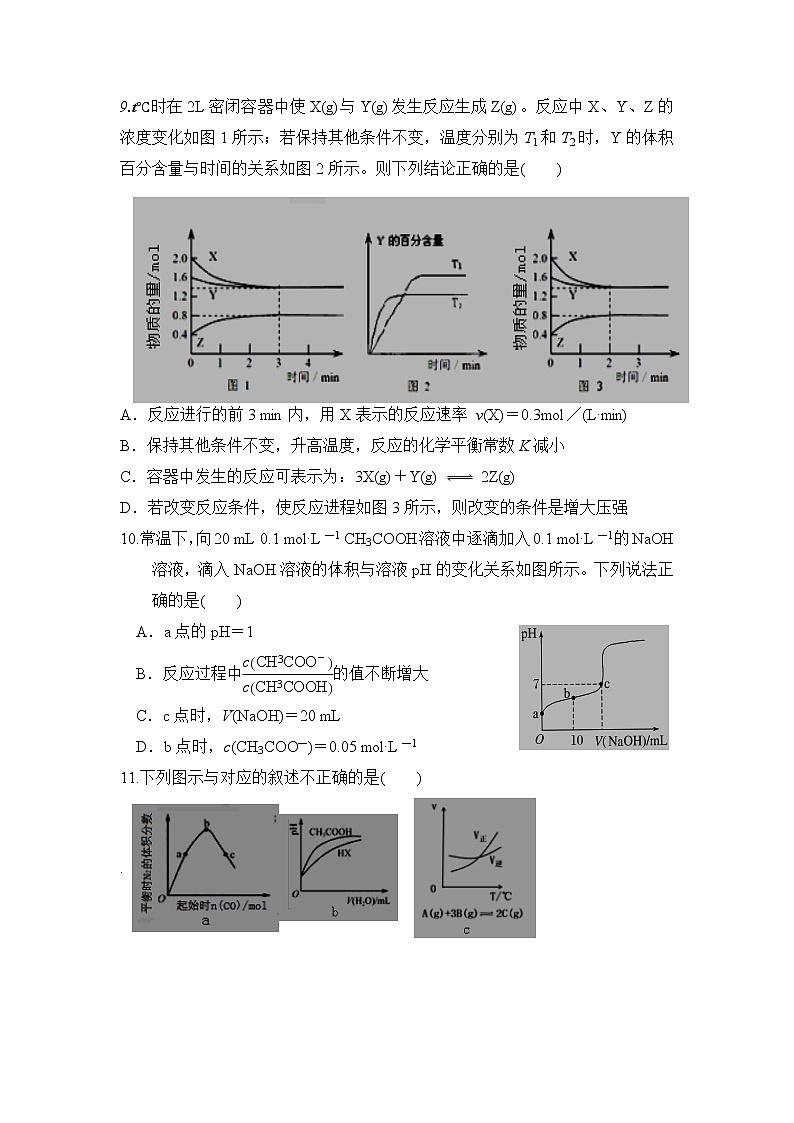
9.t℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )
A.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g)
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
10.常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法正确的是( )
A.a点的pH=1
B.反应过程中的值不断增大
C.c点时,V(NaOH)=20 mL
D.b点时,c(CH3COO-)=0.05 mol·L-1
11.下列图示与对应的叙述不正确的是( )
.
A. a表示反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
B. b表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数
C. c是其他条件一定时,反应速率随温度变化的图像,正反应△H>0
D. d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
12.下列实验操作或仪器的使用正确的是( )
A . 图1:验证镁和稀盐酸反应的热效应 B.图2:蒸发、浓缩、结晶
C.图3:蒸干AlCl3饱和溶液制备AlCl3晶体
D.图4:用酸性KMnO4标准溶液滴定Na2SO3溶液
13.下列各组离子在给定条件下一定能大量共存的是( )
A .无色透明的溶液中:MnO4- 、SO42-、K+、H+
B.含有大量AlO2-的溶液中:、、、Al3+
C.PH=11的溶液中:ClO-、、SO42-、
D.水电离出的的溶液中:、、、
14.已知:用Pt﹣Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如图①、图②所示,下列说法中,不正确的是( )
A.400℃时,生成的产物有N2、NO、H2O
B.800℃时,反应的化学方程式是:4NH3+5O2 4NO+6H2O
C.400℃﹣800℃间,Pt﹣Rh合金对N2的吸附力逐渐减弱
D.800℃以上,发生了反应:2NO(g)O2(g)+N2(g)△H>0
15.已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的HF和HClO溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅱ为HF稀释时pH变化曲线
B.取等体积b、c两点的酸溶液,中和相同浓度的NaOH 溶液,消耗NaOH的体积较小是HClO
C.溶液中水的电离程度:a>c>b>d
D.从b点到d点,溶液中 保持不变(HR代表HClO 或HF)
16.下列说法不正确的是( )
A. 常温下,将pH=4的盐酸1mL稀释至100 mL后,pH等于6
B. 常温下,pH均为3的醋酸和硝酸溶液,醋酸的浓度大于硝酸的浓度
C. 常温下,pH为1的硝酸溶液中加入等体积pH为13氢氧化钡溶液恰好完全中和
D. 若V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,则V1≤V2
17.将一定量纯净的氨基甲酸铵置于体积不变的密闭真空容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡H2NCOONH4(s)2NH3(g)+CO2(g)。
下列各说法能判断该反应已经达到化学平衡的是( )
①2v(NH3)=v(CO2) ②密闭容器中总压强不变
③密闭容器中混合气体的密度不变 ④密闭容器中氨气的体积分数不变
⑤密闭容器中c(NH3)不变
⑥密闭容器中混合气的平均相对分子质量不变
A.②③⑤ B.②③⑥ C.①④⑥ D.②③④⑤
18.实验操作对应的现象与结论均正确的是 ( )
选项
实验操作
现象
结论
A
常温下将Ba(OH)2·8H2O晶体与NH4Cl晶体在小烧杯中混合
烧杯壁变凉
该反应正向是熵减的反应
B
分别测定常温下0.1mol/LNa2SO3溶液和Na2CO3溶液的PH
PH: Na2CO3>Na2SO3
非金属性:
C
将0.1mol/L的弱酸HA稀释成0.01mol/L,测量稀释前后溶液 pH
pH增大
稀释后HA电离程度减小
D
向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,
溶液红色变浅
证明Na2CO3溶液中存在水解平衡
19.有① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是( )
A. 3种溶液pH的大小顺序是③>②>①
B. 若将3种溶液稀释相同倍数,pH变化最大的是②
C. 若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D. 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
20.在3个初始温度均为T ℃的密闭容器中发生反应:2SO2(g) + O2(g)2SO3(g)
ΔH < 0,下列说法错误的是( )
容器编号
容器类型
初始体积
起始物质的量/mol
平衡时SO3物质的量/mol
SO2
O2
SO3
I
恒温恒容
1.0 L
2
1
0
1.6
II
绝热恒容
1.0 L
2
1
0
a
III
恒温恒压
2.0 L
0
0
4
b
A.达平衡时,SO2的转化率α(I) = 80%
B.b > 3.2
C.平衡时v正(SO2):v(I) < v(II)
D.若起始时向容器I中充入1.0 mol SO2(g)、0.20 mol O2(g)和4.0 mol SO3(g),则反应将向正反应方向进行
二.非选择题(共50分)
21.(12分)下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是________(填字母)。
(2)下列操作合理的是________(填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaHCO3溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用500 mL容量瓶配制1 mol·L-1的氢氧化钠溶液495.5 mL
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,滴加2滴酚酞作指示剂,边滴边摇动锥形瓶,直到______________________________,这表示已经到达滴定终点。记录盐酸的终读数,重复滴定3次。若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为________mL。
(4)某学生根据三次实验分别记录有关数据如下表:
请选用其中合理数据求出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=____________。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是_______(填字母)。
A.中和滴定到达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00 mL待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后装入滴定管进行滴定
22. (14分) 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) ΔH=________kJ·mol-1 该反应的平衡常数K=________(用K1、K2、K3表示)。
(2)下列措施中,能提高(1)中CH3OH产率的有________。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2 mol CO和0.1 mol H2O(g)通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得H2的体积分数为0.1。则0~5 min内v(H2O)=_____,CO的转化率α(CO)=_______。
(4)将合成气以=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是________(填字母)。
A.ΔH<0
B.p1>p2>p3
C.若在p3和316 ℃时,起始时=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是CuMn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当约为________时最有利于二甲醚的合成。
23.(10分)研究发现,氮氧化物和硫氧化物是雾霾的主要成分。回答下列问题:
(1)已知某反应的平衡常数表达式为
请写出此反应的化学方程式
(2) 向一个固定体积的密闭容器充入 2mol A 和 1mol B,发生如下反应:2A(g)+B(g)3C(g)+D(g)△H>0,2 分钟后,反应达到平衡,C 的浓度为 1.2mol/L。①若在相同条件下,在上述容器中充入 1.5mol C 和 0.5mol D 发生上述反应,为使平衡后,C 的浓度仍为 1.2mol/L,则应再充入_______molA 和_________molB.
②若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a点改变的条件可能是_____
(4)Felix Sludt等通过计算机模拟结果,研究了在Ni -Zn催化剂表面C2H2与H2催化加成反应生成乙烷的反应历程(如图所示,其中吸附在Ni-Zn催化剂表面上的物种用■标注)。
①该历程中最大能垒(活化能)步骤的化学方程式为____________________________
②在密闭容器中充入乙烯,一定条件下发生反应C2H4(g)= C2H2(g) +H2(g),为了提高乙烯的平衡转化率,理论上可采取的措施是 。
A. 升高温度 B.减小压强 C.增大压强 D.增加C2H4
24.(14分) 下表是几种常见弱酸的电离平衡常数(25℃ )
化学式
H2CO3
CH3COOH
HClO
电离平衡常数
K1=4.3×10-7
K2=5.6×10-11
1.8×10-5
3.0×10-8
(1)根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是_______________________________。
(2) 下列反应不能发生的是______(填字母)。
a.+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=+2HClO
(3)25℃,一定浓度CH3COONa溶液的PH=9,该溶液呈碱性的原因______________(用离子方程式表示)。溶液中CH3COO-/CH3COOH=_________
(4)①100℃时,Kw=1.0×10-12将a mol∙L﹣1的醋酸与0.01 mol∙L﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,Ka
②该温度下某溶液中水电离出的c(H+)=1.0×10-12 mol∙L﹣1的溶液PH为________或__________
(5)H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间 B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率 B>A
⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
A. ③ ④ ⑥ B. ② ③⑥ C.③④⑤ D. ①②⑤
高二化学试题答案
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
A
D
A
B
A
C
C
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
D
A
C
C
D
D
A
D
C
D
二、 非选择题
21. (12分,每空2分)(1)a.b (2)AD
(3)当加入最后半滴溶液由红色变为无色,且半分钟内不变色
(4)0.1044mol·L-1 26.10
(5)CD
22.(14分,每空2分)(1)-246.1 kJ·mol-1 K12× K2× K3
(2) AC
(3) 0.003mol/(L·min) 15%
(4) AB
(5) 2.0
23(10分).(1)2NO(g)+2CO(g)N2(g)+2CO2(g) (2分)
(2) 1 0.5 (各1分)
(3) 增大压强(2分)
(4)①C2H4*+H*→C2H5* (2分) ②B(2分)
24.(14分,每空2分) (1)CH3COOH>H2CO3>HClO
(2) cd (3)CH3COO-+H2OCH3COOH+OH- 1.8×104
(4)①10-8/a-10-2 ②12或0
(5) C
相关试卷
这是一份【期中真题】黑龙江省八校2022届高三上学期期中联合考试化学试题.zip,文件包含期中真题黑龙江省八校2022届高三上学期期中联合考试化学试题原卷版docx、期中真题黑龙江省八校2022届高三上学期期中联合考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
这是一份浙江省温州十校联合体2021-2022学年高二上学期期中考试化学试题含答案,共14页。试卷主要包含了考试结束后,只需上交答题纸,下列说法正确的是,合成氨工业主要发生如下反应等内容,欢迎下载使用。
这是一份黑龙江省八校2022届高三上学期期中联合考试化学试题含答案,共11页。试卷主要包含了5 Cu-64,下列表示正确的是,5NA,下列判断不合理的一组是等内容,欢迎下载使用。








