
福建省南平市2021年高考化学二模试卷
展开
这是一份福建省南平市2021年高考化学二模试卷,共16页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
高考化学二模试卷
一、单选题
1.化学与生活、科技及环境密切相关。下列说法正确的是( )
A. 抗击新型冠状病毒用到的“84消毒液”的有效成分为
B. “建本雕版印刷技艺”使用的木质雕版主要成分为纤维素
C. 嫦娥四号采样器带回的月壤中的 属于氧化物
D. 陶瓷工艺品建盏(中国国家地理标志产品)属于新型无机非金属材料
2.已知 是阿伏伽德罗常数的值,下列说法正确的是( )
A. 中离子总数为
B. 臭氧含有的质子数为
C. 一定条件下, 与 反应生成的 分子数为
D. 溶液中 数为
3.有机物 为合成新型药物中间体,其结构简式如图。下列有关 的说法正确的是( )
A. 分子式为 B. 分子中至少有11个碳原子在同一平面上
C. 与溴水反应最多消耗 D. 既能与金属 反应又能与 溶液反应
4.下列指定反应的离子方程式错误的是( )
A. 铅蓄电池放电的总反应:Pb+PbO2+4H++2 =2PbSO4↓+2H2O
B. 足量CO2通入溶有氨的饱和食盐水:CO2+NH3+H2O+Na+=NaHCO3↓+
C. 明矾溶液中滴加Ba(OH)2溶液至沉淀质量最大:
D. 氯气在碱性环境下将I-氧化成 :
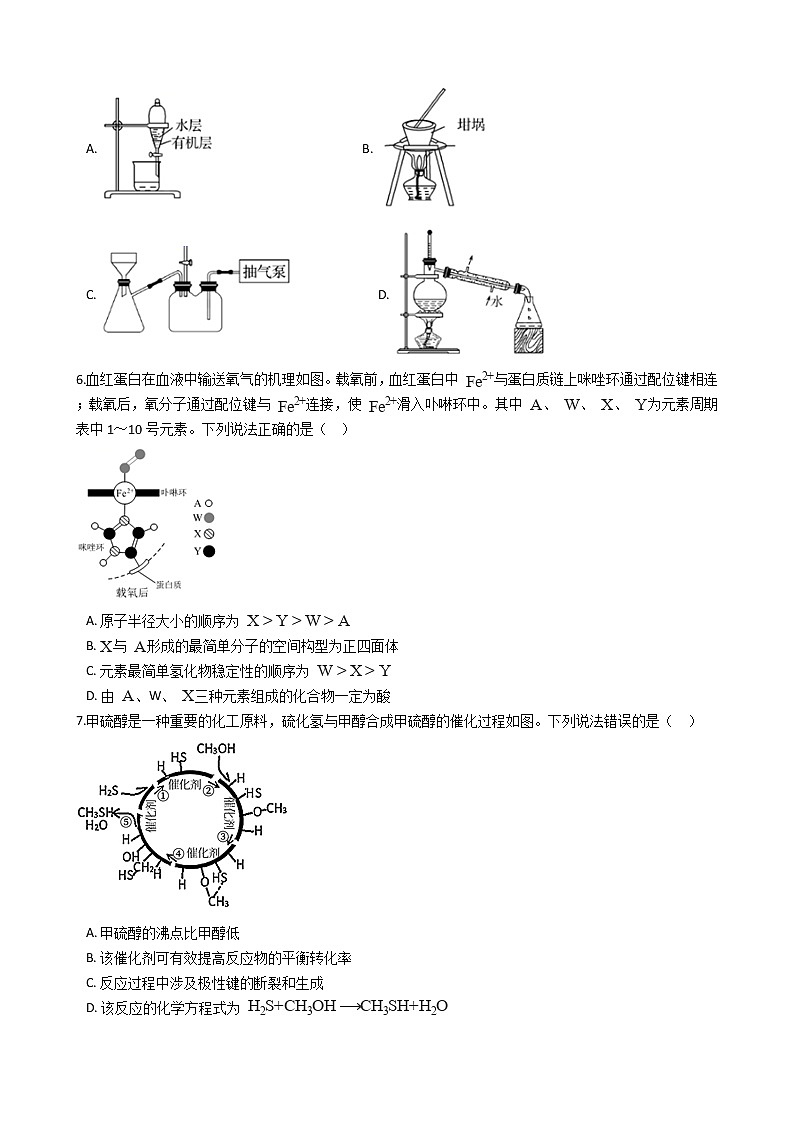
5.从干海带中提取 的流程如图,在实验室利用该流程提取 中不涉及的操作是( )
A. B.
C. D.
6.血红蛋白在血液中输送氧气的机理如图。载氧前,血红蛋白中 与蛋白质链上咪唑环通过配位键相连;载氧后,氧分子通过配位键与 连接,使 滑入卟啉环中。其中 、 、 、 为元素周期表中1~10号元素。下列说法正确的是( )
A. 原子半径大小的顺序为
B. 与 形成的最简单分子的空间构型为正四面体
C. 元素最简单氢化物稳定性的顺序为
D. 由 、W、 三种元素组成的化合物一定为酸
7.甲硫醇是一种重要的化工原料,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法错误的是( )
A. 甲硫醇的沸点比甲醇低
B. 该催化剂可有效提高反应物的平衡转化率
C. 反应过程中涉及极性键的断裂和生成
D. 该反应的化学方程式为
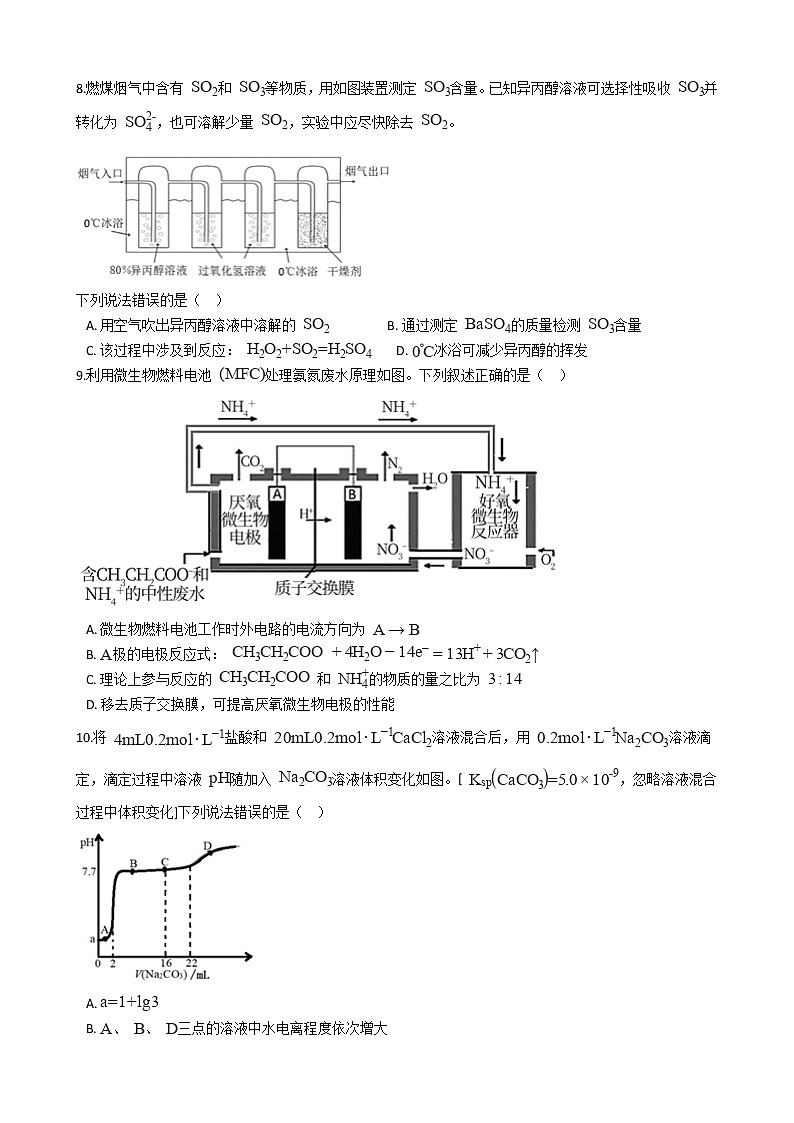
8.燃煤烟气中含有 和 等物质,用如图装置测定 含量。已知异丙醇溶液可选择性吸收 并转化为 ,也可溶解少量 ,实验中应尽快除去 。
下列说法错误的是( )
A. 用空气吹出异丙醇溶液中溶解的 B. 通过测定 的质量检测 含量
C. 该过程中涉及到反应: D. 冰浴可减少异丙醇的挥发
9.利用微生物燃料电池 处理氨氮废水原理如图。下列叙述正确的是( )
A. 微生物燃料电池工作时外电路的电流方向为
B. 极的电极反应式:
C. 理论上参与反应的 和 的物质的量之比为
D. 移去质子交换膜,可提高厌氧微生物电极的性能
10.将 盐酸和 溶液混合后,用 溶液滴定,滴定过程中溶液 随加入 溶液体积变化如图。[ ,忽略溶液混合过程中体积变化]下列说法错误的是( )
A.
B. 、 、 三点的溶液中水电离程度依次增大
C. 点溶液中存在:
D. 点
二、非选择题
11.华为公司近年开发出石墨烯高能钴酸锂电池,该电池正极铝钴膜主要成分钴酸锂 ,还含有少量的铝、铁、碳等单质。实验室对废旧钴酸锂电池回收利用的流程如图:
已知:①还原性:
② 和 结合生成较稳定的 ,强酸性条件下分解生成
回答下列问题:
(1)“碱浸泡”时,为提高碱浸泡效率,可采取的措施有________(写一条)。
(2)从含铝废液得到固体 的离子方程式为________。
(3)滤液 与滤液 中均含有的主要溶质为________(填化学式)。 和盐酸反应的化学方程式为________。
(4)已知 , ,则反应 的平衡常数为________。
(5)将滤液 加入过量盐酸后,再经过________、过滤、洗涤、干燥得到 晶体。
(6)为测定产品中草酸钴晶体 的纯度,先称取 样品,将其中草酸钴晶体转化成草酸铵 溶液并用稀硫酸酸化,再用 溶液滴定,达到滴定终点时,共用去 溶液 。滴定时 溶液应盛放在________滴定管,草酸钴晶体的纯度为________。
12.习近平总书记在科学家座谈会上指出“好奇心是人的天性,对科学兴趣的引导和培养要从娃娃抓起”。某化学兴趣小组为培养同学们对科学探究的兴趣,设计图1所示实验来探究 与Cu2+的反应:
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:
(1)若用CuSO4·5H2O配制100 mL 1 mol/LCuSO4溶液,需用托盘天平称取CuSO4·5H2O的质量为________。甲同学在定容时采用上图2方式观察,则所配制的CuSO4溶液浓度________(填“偏高”或“偏低”)。
(2)将操作2后生成的无色气体通入氯化铁溶液,________(填实验现象),说明该气体为SO2 , 反应的离子方程式为________。
(3)操作2后生成的白色沉淀为________(填化学式),生成该沉淀和无色气体的反应离子方程式为________。
(4)根据氧化还原反应的规律,乙同学推测操作2中涉及 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于 ,用图3装置(a、b均为石墨电极)进行实验验证。
①K闭合时,一段时间后指针几乎归零。
②向U型管右管添加________,a电极为________极,产生的现象证实了其推测,其中不同于图1操作2后的现象是________。
(5)基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与________有关。该同学用图3装置再次进行实验,以丰富验证该猜想的证据。与(4)实验对比,不同的操作是向U型管左管添加________。
13.二氧化碳的综合利用是环保领域研究的热点课题。
(1)Ⅰ. 经过催化氢化合成低碳烯烃。
合成乙烯的反应为
已知几种化学键键能如下表所示:
物质
能量
则 ________(用含字母的代数式表示)。
(2)反应温度、投料比 对 平衡转化率的影响如图1。
① ________3(填“>”“”或“3;由图可知其他条件相同时,温度升高,二氧化碳的平衡转化率减小,因此该反应为放热反应,温度越高,平衡常数K越小,因此 > ;
② 时,往 刚性密闭容器中加入 、 , =x=3,由图可知200℃、x=3时,二氧化碳平衡转化率为0.6,列三段式: ,因此反应开始和平衡时的总压强比=(3+1):(1.2+0.4+0.3+1.2)=4:3.1=40:31;
(3)由图2可知,370℃时低碳烯烃选择性高, 转化率较高,因此该反应最适宜的温度为370℃;原因为在此温度下低碳烯烃选择性高, 转化率较高;
Ⅱ.(4)①阴极得电子,化合价降低,发生还原反应,结合图可知阴极生成氢气的电极反应式为 ;
②a.由积碳反应可知生成固体碳,生成的碳覆盖在电极表面,影响电极的催化活性,a正确;
b.积碳反应生成的碳附着在电极表面,影响电极活性,使电解效率降低,b正确;
c.积碳反应在阴极发生,氧气在阳极产生,因此生成的碳不会和电解产生的氧气反应,c不正确;
选ab。
【分析】(1)根据焓变=反应物的键能-生成物的键能即可计算
(2)① 相同条件下,氢气的量越多,二氧化碳的转化率越高,根据二氧化碳的转化率即可判断a的大小,温度越高转化率越小,说明反应是放热,温度升高,平衡常数减小②根据M的转化率即可计算出平衡各物质的物质的量,根据压强和体积不变,压强与物质的量呈正比即可计算
(3)根据图示即可判断低碳烯烃的选择性高即可判断温度大小
(4)①阴极是水得到电子得到氢气和氧离子即可写出电极式②积碳反应碳是固体附着在催化剂表面阻碍与反应物的接触,降低活性和催化效率,氧气是在阳极产生不与与碳反应
14.【答案】 (1)或 ;哑铃形(或纺锤形)
(2);
(3)
(4)12;正四面体
(5)
【解析】【解答】(1)Ga为第31号元素,基态 原子核外电子排布式为 或 ,最高能级为p,电子的电子云形状为哑铃形(或纺锤形)。
(2) 和 为结构相似的原子晶体,原子半径越小,作用力越强,熔沸点越高,沸点 < ,同周期元素从左到右第一电离能逐渐增大,As的4p能级含有3个电子,为半满稳定状态,第一电离能较高,则第一电离能As>Ga。
(3)成语“信口雌黄”中雌黄的分子式为 ,分子结构如图1,As是中心原子,H原子是配体,中心原子As有5个价电子,配体3个H有3个价电子,共8个价电子,4个电子对,其中3个成键电子对,1个孤对电子As采取sp3杂化。
(4)晶体中砷原子的堆积方式为面心立方,与一个砷原子距离最近且等距离的砷原子数为12,晶体中一个镓原子通过四个共价键结合四个砷原子,镓原子位于由砷原子构成的正四面体空隙中。
(5)晶体中镓原子与砷原子的最小核间距即Ga- As键的键长,该距离是晶胞体对角线的四分之一,已知晶胞边长为apm,则晶胞体对角线为 apm,镓原子与砷原子的最小核间距为 。
【分析】(1)根据Ga原子的核外电子数结合能级排布即可写出核外电子能级排布,根据能级排布即可找出最高能级的电子云形状
(2) 和 为结构相似的原子晶体 ,晶体的沸点与键长有关,键长越短,沸点越高,键长与半径有关,半径越小键越短,沸点越高,能级上的电子半充满或者全充满时第一电离能较高,而 存在半充满的能级
(3)根据图1判断形成3个键且含有1对孤对电子为sp3杂化
(4)根据晶胞结构,与As距离最近的As是面心和顶点的距离和面心与面心的距离,故有12个,Ga处于4个As原子形成的正四面体中
(5)根据晶胞示意图即可得出Ga与As的距离是体对角线的计算出即可
15.【答案】 (1)二甲基丙醛;(酚)羟基、醚键
(2)
(3)酯化反应或取代反应
(4)
(5)12;
【解析】【解答】(1)经分析,B的结构简式为 ,根据系统命名法,其名称为 二甲基丙醛;通过I的结构简式可知其结构中含有羟基和醚键。
(2)通过D和E的反应条件,可知反应是醇脱氢氧化反应,则其反应方程式为 。
(3)经分析F的结构简式为 ,I的结构中含有醇羟基,故F和I的反应是酯化反应或取代反应。
(4)经分析H的结构简式为 ,其结构中含有卤素原子和一个酚羟基,故 与 溶液反应时最多消耗 的物质的量为 。
(5)苯环上有两个取代基且能使 溶液变紫色的 的同分异构体,且其结构中一定含有一个酚羟基,则满足条件的同分异构体有 、 、 、 且每种同分异构都有邻、间、对三种,则满足条件的同分异构体总计12种,其中不含甲基的同分异构体的结构简式为 。
【分析】由已知信息,结合D的结构简式,结合C→D的条件,可知C的结构简式为 ,C是由CH3CHO和B反应生成的,结合题目的已知信息,可知B的结构简式为 ,由D→E结合D的官能团和反应条件,可知反应是醇脱氢氧化反应,则E的结构简式为 ,E→F通过反应条件可知E中醛基被氧化成羧基,则F的结构简式为 ,则F和I的反应是酯化反应,G和Cl2反应是取代反应,故H结构简式为 据此分析解答。
相关试卷
这是一份2023届福建省南平市高三三模化学试题,文件包含2023学年高三市三检试卷参考答案评分细则pdf、高三化学试题pdf等2份试卷配套教学资源,其中试卷共5页, 欢迎下载使用。
这是一份2021-2022学年福建省南平市高二(上)期末化学试卷(含答案解析),共18页。试卷主要包含了4ml电子转移,则有0,33g,80℃时0,25∼2,【答案】B,【答案】D,【答案】C,【答案】A等内容,欢迎下载使用。
这是一份2022届福建省南平市高三三模化学试题及答案,共27页。









