

- 第04讲 氨、铵盐、硝酸(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案 教案 1 次下载
- 第05讲 无机非金属材料(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案 教案 2 次下载
- 第07讲 化学反应与电能(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案 教案 1 次下载
- 第08讲 化学反应速率(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案 教案 1 次下载
- 第09讲 化学反应的限度(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案 教案 1 次下载
第06讲 化学反应与热能(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案
展开
一、化学反应的本质和特征
1.本质:
(1)化学反应的本质是旧化学键的_______和新化学键的_______。
(2)断开化学键要_______能量,形成化学键要______能量,吸收的能量与释放的能量__________。
2.特征:
(1)生成新物质(符合质量守恒定律);
(2)释放能量或吸收能量(符合能量守恒定律)。
【答案】(1)断裂 形成 (2)吸收 放出 不相等
明辨是非
【答案】××√; √×√
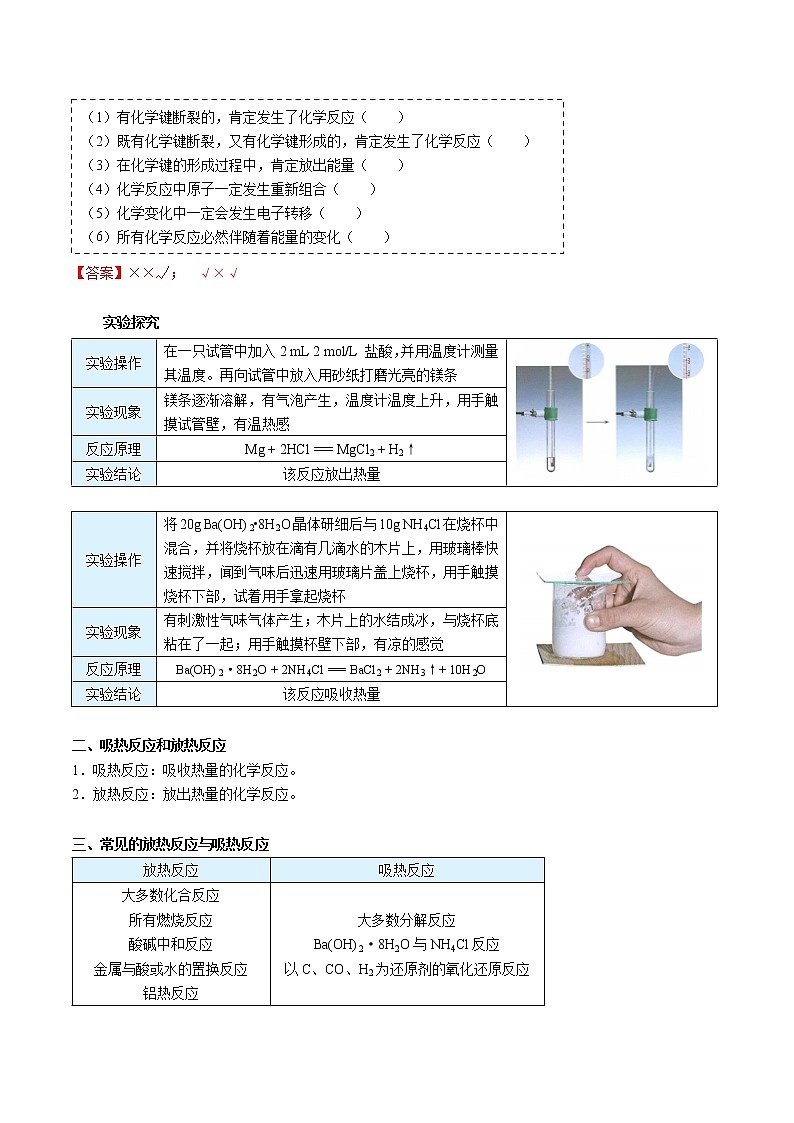
实验探究
实验操作 | 在一只试管中加入2 mL 2 mol/L 盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条 | |
实验现象 | 镁条逐渐溶解,有气泡产生,温度计温度上升,用手触摸试管壁,有温热感 | |
反应原理 | Mg + 2HCl === MgCl2 + H2↑ | |
实验结论 | 该反应放出热量 |
实验操作 | 将20g Ba(OH)2•8H2O晶体研细后与10g NH4Cl在烧杯中混合,并将烧杯放在滴有几滴水的木片上,用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯 | |
实验现象 | 有刺激性气味气体产生;木片上的水结成冰,与烧杯底粘在了一起;用手触摸杯壁下部,有凉的感觉 | |
反应原理 | Ba(OH)2·8H2O + 2NH4Cl === BaCl2 + 2NH3↑+ 10H2O | |
实验结论 | 该反应吸收热量 |
二、吸热反应和放热反应
1.吸热反应:吸收热量的化学反应。
2.放热反应:放出热量的化学反应。
三、常见的放热反应与吸热反应
放热反应 | 吸热反应 |
大多数化合反应 所有燃烧反应 酸碱中和反应 金属与酸或水的置换反应 铝热反应 | 大多数分解反应 Ba(OH)2·8H2O与NH4Cl反应 以C、CO、H2为还原剂的氧化还原反应 |
明辨是非
【答案】 ××××
【总结1】吸热反应和放热反应的对象都是化学变化,物理变化除外。
【总结2】一个化学反应是吸热还是放热,与反应条件(是否需要加热)没有必然联系。
- 化学反应的本质与能量变化
【例1】下列说法正确的是( )
A.物质发生化学变化都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.物质变化时若伴有能量变化,则一定是化学变化
D.没有物质的化学变化,也就没有能量的变化
【答案】A
- 吸热反应与放热反应的判断
【例2】下列是吸热反应的是__________
① 水蒸气冷凝 ② 煅烧石灰石 ③ 浓硫酸稀释 ④ 酸碱发生中和反应
⑤ 生石灰跟水反应生成熟石灰 ⑥ 干冰升华 ⑦ 液氨汽化
⑧ 碳和二氧化碳在高温下反应 ⑨ 氢原子两两结合为氢分子
【答案】②⑧
【变2-1】下列变化中属于吸热反应的是( )
①冰融化成水 ②胆矾受热分解 ③浓硫酸加水稀释 ④高锰酸钾分解制取氧气
⑤生石灰与水反应生成熟石灰 ⑥石灰石高温分解 ⑦CO2 + C 2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合 ⑨C + H2O(g) CO + H2
A.②④⑥⑦⑨ B.①②④⑥⑦⑧⑨
C.②③④⑤⑥⑧ D.②④⑥⑦⑧⑨
【答案】D
【变2-2】把下列物质分别加入盛冷水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图变化( )
① NaOH粉末;② 浓硫酸;③ 硝酸铵晶体;④ 过氧化钠固体;⑤ 生石灰。
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
【答案】A
- 吸热反应与放热反应的实验探究
【例3】在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体 [Ba(OH)2·8H2O],将小烧杯放在事先已滴有3 ~ 4滴水的木片上,然后向烧杯内加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌,如图所示。
试回答下列问题:
(1)实验中要立即用玻璃棒迅速搅拌的原因是__________________________________________________。
(2)如果实验中没有看到“结冰”现象,可能的原因是___________________________________________
____________________________________________________________________________________________
____________________________________________(答出3个或3个以上原因)。
(3)如果没有看到“结冰”现象,为说明该反应吸热,我们还可以采取的方式是_____________________
__________________________________。
【答案】(1)使反应物迅速混合而充分反应,使温度迅速下降
(2)① 药品用量太少;② Ba(OH)2·8H2O晶体未研成粉末,反应太慢;③ 没有迅速搅拌;
④ 环境温度太高;⑤ 玻璃片上加水太多等
(3)用温度计来检验,发现温度降低等。
【变3】为了探究化学反应的热效应,某兴趣小组进行了如下实验:
(1)将纯固体物质分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。
①若如图1所示,发生的反应(假设没有气体生成)是________(填“放热”或“吸热”)反应,是________(填两种物质的化学式)。
②若如图2所示,发生的反应(假设没有气体生成)是________(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是________(填序号)。
A.CO还原CuO的反应 B.CaCO3的分解反应 C.Al和Fe2O3的反应
(2)如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放几小块镁片,再滴入稀盐酸。试回答下列问题:
①实验中观察到的现象是:镁片逐渐溶解、有大量气泡产生、________________________________。
②产生上述现象的原因是____________________________________。
【答案】(1)①放热 Na、Na2O或CaO(填两种即可) ② 吸热 B
(2)饱和澄清石灰水中出现白色浑浊 镁和稀盐酸反应生成H2,且该反应是放热反应,Ca(OH)2的溶解度随温度的升高而降低
一、从化学键的角度分析化学反应的能量变化
1.键能:断开(形成)1 mol某化学键所吸收(放出)的能量叫键能。单位:kJ/mol。
例如,断开(形成)1 mol H-H键吸收(放出)的能量为436.0 kJ,那么H-H键的键能是436.0 kJ/mol 。
2.化学键的断裂和形成是化学反应中能量变化的主要原因:
(1)若吸收能量E1>释放能量E2,该反应为吸热反应;
(2)若吸收能量E1<释放能量E2,该反应为放热反应。
3.实例
化学键 | H﹣H | Cl﹣Cl | H﹣Cl |
键能kJ/mol | 436 | 243 | 431 |
从键能角度分析H2 +Cl2 2HCl 反应体系中能量变化情况。
1 mol H2与1 mol Cl2反应生成2 mol HCl分子的过程中, 了 kJ的能量。
【答案】 吸收;吸收;431;431;释放;183。
及时小练
【答案】2 mol H2与1 mol O2反应生成2 mol H2O分子,放出490 kJ的能量。
二、从总能量的角度分析化学反应的能量变化
1.一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
(1)若反应物总能量E反>生成物总能量E生,该反应为放热反应;
(2)若反应物总能量E反<生成物总能量E生,该反应为吸热反应。
E反 ___ E生 ,______ 反应 E反 ___ E生 ,______ 反应
【答案】>,放热;<,吸热。
2.吸热反应与放热反应的真实能量变化图:
E吸 < E放,放热反应 | E吸 > E放,吸热反应 |
资料卡片——能量与稳定性
- 能量变化图
【例4】已知反应A + B === C + D的能量变化如图所示,下列关于此反应的说法不正确的是( )
A.是吸热反应
B.该反应不符合能量守恒定律
C.生成物的总能量高于反应物的总能量
D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
【答案】B
【变4】反应A + B → C(放热)分两步进行:① A + B → X(吸热),② X → C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A | B | C | D |
【答案】D
- 键能的计算
【例5】已知部分键能如下表所示,计算下列三个反应中的能量变化情况。
化学键 | H—H | H—N | N≡N | O=O | C—H | C=O | H—O | P—P | P—O |
键能 (kJ/mol) | 436 | 391 | x | 498 | 414 | 750 | 465 | 198 | 360 |
(1)CH4 + 2O2 CO2 + 2H2O,1 mol CH4完全反应时,_________(填吸收/放出)________ kJ能量。
(2)已知N2 + 3H2 2NH3,消耗1 mol N2 时放出92 kJ的热量,则上表中x的数值为 ________。
(3)如下图为白磷(P4)和P4O6的结构,1mol 白磷完全燃烧,________(填吸收/放出)________kJ能量。
【答案】 (1)放出,708;(2)946;(3)放出,1638
【变5】NF3是一种温室气体,其存储能量的能力是CO2的12000 ~ 20000倍,在大气中的寿命可长达740年,如表所示是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/kJ·mol-1 | 946 | 154.8 | 283.0 |
下列说法中正确的是( )
A.过程N2(g) → 2N(g)放出能量
B.过程N(g) + 3F(g) → NF3(g)放出能量
C.反应N2(g)+3F2(g) === 2NF3(g)是吸热反应
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
【答案】B
- 能量越低越稳定
【例6】金刚石和石墨是由C元素组成的两种结构不同的单质。在100 kPa时,1 mol石墨转化为金刚石,要吸收1.895 kJ的能量。据此判断, 在100 kPa时,下列结论正确的是( )
A.1 mol石墨比1 mol金刚石的总能量高
B.金刚石比石墨稳定
C.石墨比金刚石稳定
D.1 mol石墨与1 mol金刚石的总能量相等
【答案】 C
【变6-1】如图表示有关反应的反应过程与能量变化的关系,据此判断下列说法中不正确的是( )
A.红磷和白磷互为同素异形体
B.白磷比红磷稳定
C.白磷转化为红磷是放热反应
D.白磷比红磷更容易与氧气反应生成P4O10
【答案】 B
【变6-2】已知25℃、101 kPa下,含1 mol碳原子的石墨完全燃烧生成CO2放出热量393.51 kJ;含1 mol碳原子的金刚石完全燃烧生成CO2放出395.41 kJ的热量。据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;石墨比金刚石稳定
B.由石墨制备金刚石是吸热反应;金刚石比石墨稳定
C.由石墨制备金刚石是放热反应;石墨比金刚石稳定
D.由石墨制备金刚石是放热反应;金刚石比石墨稳定
【答案】 A
一、人类对能源的利用
1.获取热能的途径——物质的燃烧
(1)早期:以树枝杂草为主要能源。
(2)现代:以煤、石油和天然气为主要能源。
2.面临问题
(1)短期内不可再生,储量有限;
(2)煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等造成大气污染。
3.解决方法
(1)节能减排
(2)开发利用新能源
明辨是非
【答案】××√×; √×√×
- 能源的利用
【例7】下列叙述不正确的是( )
A.开发氢能、太阳能、风能、生物质能等新能源是践行低碳生活的有效途径
B.火力发电是将燃料中的化学能直接转化为电能的过程
C.利用生物质能就是间接利用太阳能
D.绿色植物进行光合作用时,将太阳能转化为化学能
【答案】B
【变7】氢气是未来的理想能源,理由是( )
①燃烧放热多 ②燃烧时不污染环境
③用于制取H2的水资源丰富 ④密度小,便于运输
A.①②③ B.②③④ C.①③④ D.①②③④
【答案】A
【练1】下列说法错误的是( )
A.化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量的相对大小
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的化学反应一定是吸热反应
D.反应物的总能量高于生成物的总能量时,发生放热反应
【答案】C
【练2】如图所示,有关化学反应和能量变化的说法正确的是( )
A.图a表示的是吸热反应的能量变化
B.图b中生成物比反应物稳定
C.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
D.图a不需要加热就一定能发生,图b一定需要加热才能发生
【答案】C
【练3】“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( )
A.煤炭、石油、潮汐能 B.水能、生物质能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
【答案】C
【练4】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂 1 mol N—N键吸收193 kJ热量,断裂 1 mol N≡N键吸收941 kJ热量,则下列说法不正确的是( )
A.N4与N2互为同素异形体
B.1 mol N4气体转化为N2时要放出724 kJ能量
C.N4变成N2是化学变化
D.2 mol N2的能量比1 mol N4的能量高
【答案】D
【练5】下列反应中旧化学键断裂吸收的总能量大于新化学键形成放出总能量的是( )
A.电解水制取H2和O2 B.甲烷燃烧
C.铝粉与氧化铁粉末反应 D.铁与稀盐酸反应
【答案】A
【练6】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O形成了具有极性共价键的CO2
D.状态Ⅰ → 状态Ⅲ 表示CO与O2反应的过程
【答案】C
【练7】化学反应A2 + B2 === 2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键能放出x kJ能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
【答案】C
【练8】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是_________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是__________________________________,说明该反应属于_______(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是______________________________________________
______________________________________________;
②若观察到烧杯里产生气泡,则说明M溶于水_________________________(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是_________________________________________________
______________________________________________。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2 + 2H2O === 4KOH + 3O2↑)是放热反应。
方法①:选择上述装置_________________(填“Ⅰ”、“Ⅱ”或“Ⅲ”)进行实验。
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到_________________,则说明该反应是放热反应。
【答案】(1)III(2)左端液柱降低,右端液柱升高;放热
(3)①产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱;②可能是放热反应;有热量放出不一定为化学变化,所以不一定属于放热反应,也可能是反应产生气体。
(4)Ⅰ(或Ⅱ);棉花燃烧
第09讲 化学反应的限度(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案: 这是一份第09讲 化学反应的限度(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案,共12页。
第08讲 化学反应速率(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案: 这是一份第08讲 化学反应速率(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案,共12页。
第07讲 化学反应与电能(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案: 这是一份第07讲 化学反应与电能(讲义)(教师版)-【精准提分】2020-2021学年高一化学必修第二册同步培优(新教材人教版)教案,共14页。












