





所属成套资源:2021化学人教版(2019) 一轮复习 课件+学案
- 第1讲 物质的量 气体摩尔体积课件PPT 课件 0 次下载
- 第1讲 物质的量 气体摩尔体积学案 学案 0 次下载
- 第2讲 物质的量浓度及一定物质的量浓度溶液的配制学案 学案 0 次下载
- 微专题1 阿伏加德罗常数的判断学案 学案 1 次下载
- 第2讲 离子反应课件PPT 课件 0 次下载
第2讲 物质的量浓度及一定物质的量浓度溶液的配制课件PPT
展开
这是一份第2讲 物质的量浓度及一定物质的量浓度溶液的配制课件PPT,共56页。
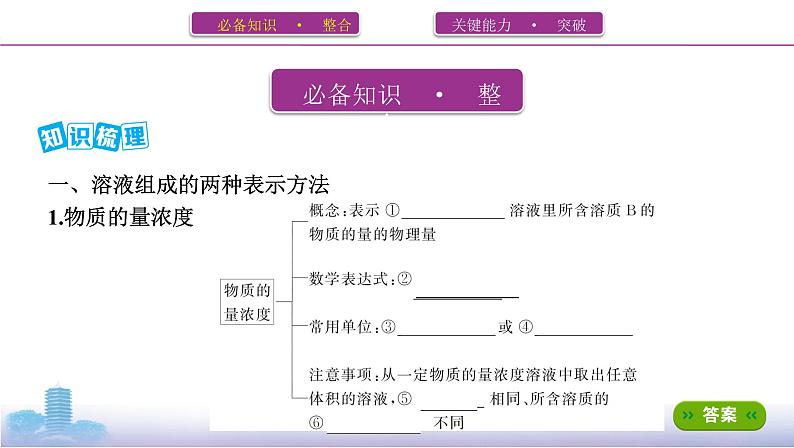
一、溶液组成的两种表示方法
思考1 从一瓶500 mL 0.4 ml·L-1的NaCl溶液中取出10 mL溶液,其浓度是多
少?其中含有NaCl的物质的量为多少?
提示 0.4 ml·L-1,0.004 ml
2.溶质的质量分数(1)概念:用溶质的质量与溶液质量的比值来表示溶液组成的物理量,符号为ω,
一般用百分数表示。(2)表达式:ω= ×100%。(3)饱和溶液中溶质的质量分数用溶解度S表示:ω= ×100%。
思考2 将80 g SO3溶于120 mL水中所得溶液的溶质质量分数为多少?
提示 49%。80 g SO3溶于水,与水反应生成98 g硫酸,溶液质量为200 g,所以
得到的硫酸溶液的溶质质量分数为49%。
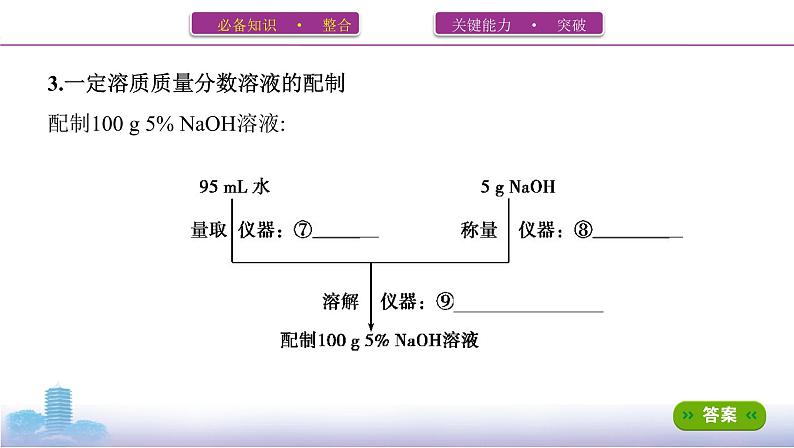
3.一定溶质质量分数溶液的配制配制100 g 5% NaOH溶液:
二、一定物质的量浓度溶液的配制
1.主要仪器(1)托盘天平称量前先调零,称量时药品放在⑩ 左盘 ,砝码放在 右盘 ,读数精确到 0.1 g。(2)容量瓶a.构造及用途:
(3)其他仪器:量筒、烧杯、玻璃棒、 胶头滴管 等。
思考3 在50 mL量筒中可以配制0.100 0 ml·L-1碳酸钠溶液吗?为什么?
提示 不可以。量筒只能用来量取液体,不能用来进行溶液的配制。
2.配制过程以配制500 mL 1.00 ml·L-1NaOH溶液为例。(1)配制步骤
思考4 在溶液的配制过程中,有3次用到玻璃棒,作用分别是什么?
提示 第1次是溶解氢氧化钠,搅拌,加速溶解;第2次是向容量瓶中移液,引流;
第3次是将洗涤液转入容量瓶,玻璃棒的作用也是引流。
1.易错易混辨析(正确的画“√”,错误的画“✕”)(1)从100 mL 5 ml·L-1H2SO4溶液中取出了20 mL,所得硫酸的物质的量浓度为
1 ml·L-1 ( )(2)将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度为1 ml·L-1
( )(3)将10 g CaCO3粉末加入水中配成100 mL溶液,所得溶液的浓度为1 ml·L-1
( )(4)将0.5 ml·L-1的NaCl溶液100 mL蒸发掉50 g水,所得溶液的浓度为1 ml·L-1
( )
(5)将20 mL 2 ml·L-1NaCl溶液与20 mL水混合,所得的溶液浓度为1 ml·L-1 ( )(6)NaOH固体放入小烧杯中,然后加入蒸馏水,为防止氢氧化钠溶液与空气中
的CO2反应,溶解后应立即转移到容量瓶中 ( )(7)配制2 ml·L-1Na2CO3溶液950 mL时,应选1 000 mL容量瓶,称取Na2CO3·10H2O 572.0 g ( )(8)配制0.100 0 ml·L-1氯化钠溶液时,两次用玻璃棒的作用相同 ( )(9)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 ( )(10)用量筒量取20 mL 0.500 0 ml·L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.100 0 ml·L-1 H2SO4溶液 ( )
2.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定
容等操作。下列图示对应的操作规范的是 ( )
3.下列关于2 ml·L-1 Ba(NO3)2溶液的说法正确的是 ( )A.100 mL溶液中N 的浓度是0.4 ml·L-1B.500 mL溶液中N 的物质的量是4 mlC.500 mL溶液中含有Ba2+的质量是137 gD.100 mL溶液中所含Ba2+、N 总数为0.4NA
解析 硝酸根离子的浓度是硝酸钡的2倍,则100 mL溶液中N 的浓度是4 ml·L-1,A错误;500 mL溶液中N 的物质的量是0.5 L×4 ml·L-1=2 ml,B错误;500 mL溶液中含有Ba2+的质量是0.5 L×2 ml·L-1×137 g·ml-1=137 g,C正确;
100 mL溶液中所含硝酸钡的物质的量是0.2 ml,因此Ba2+、N 总数为0.6NA,D错误。
4.将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。(1)该溶液中NaOH的物质的量浓度为 6.1 ml·L-1 。(2)该溶液中NaOH的质量分数为 20% 。(3)从该溶液中取出10 mL,含NaOH的质量为 2.44 g ,含NaOH的物质的量
为 0.061 ml 。(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量
浓度为 0.61 ml·L-1 。
解析 24.4 g NaOH的物质的量为 =0.61 ml,溶液质量为100 mL×1.219 g·mL-1=121.9 g。(1)该溶液中NaOH的物质的量浓度为 =6.1 ml·L-1。(2)该溶液中NaOH的质量分数为 ×100%≈20%。(3)溶液是均匀的,取出10 mL,溶液中氢氧化钠的质量、物质的量为原溶液的 ,分别为2.44g、0.061 ml。(4)取出的10 mL溶液加水稀释到100 mL,稀释后溶液中
NaOH的物质的量浓度为 =0.61 ml·L-1。
考点一 溶液的浓度及相关计算
1.计算方法(1)利用公式直接计算:c= 。(2)利用溶质的质量分数计算。c为溶质的物质的量浓度,单位:ml·L-1,ρ为溶液密度,单位:g·cm-3,ω为溶质的质
量分数,M为溶质的摩尔质量,单位:g·ml-1,则c= = = = 。(3)电荷守恒:一般用于离子浓度的计算,如Na2SO4溶液中存在c(Na+)=2c(S )。
2.有关物质的量浓度计算的常见类型(1)标准状况下气体溶质溶于水所得溶液浓度的计算 c= (2)溶液稀释、同种溶质的溶液混合的计算
例1 标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液
的密度为ρ g·mL-1,质量分数为ω,物质的量浓度为c ml·L-1,则下列关系中不正
确的是 ( )A.ρ= B.ω= C.ω= D.c=
解析 由c= 可推出B项正确。m(NH3)= ml×17 g·ml-1= g,m(溶液)=m(NH3)+m(水)=( +1 000)g,ω= = ÷( +1 000)= ,C项正确。把C项代入c= ,得c= ,D项正确。A项中,把式子变形得ρ= ,显然,是把溶液的体积按(1+V)L来计算的,所以错误。
易错提醒 物质的量浓度中的体积是指溶液的体积,而不是指溶剂的体积,不
能用水的体积代替,若两溶液混合,溶液的体积也不是两溶液体积之和。
例2 (1)在100 g物质的量浓度为c ml·L-1,密度为ρ g·cm-3的硫酸中加入一定
量的水稀释成 ml·L-1的硫酸,则加入水的体积 ”或“ 100 mL。 (3)若把(1)(2)中的物质的量浓度均改为溶质的质量分数,则加入水的体积 = 100 mL。
解析 (1)设加入水的体积为V mL,则 c= · ,由于ρ'
相关课件
这是一份化学必修 第一册第三节 物质的量优秀课件ppt,文件包含第18讲+一定物质的量浓度溶液的配制pptx、第18讲一定物质的量浓度溶液的配制教师版docx、第18讲一定物质的量浓度溶液的配制学生版docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
这是一份人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液精品课件ppt,共36页。PPT课件主要包含了看谁做得既准又快,学习目标,你将准备如何配制,问题探究,物质的量浓度溶液配制,溶液的配制,计算→称量→溶解,烧杯或量筒或其他仪器,评一评,哪种量筒精确度高等内容,欢迎下载使用。
这是一份必修 第一册第三节 物质的量优质课件ppt,共21页。PPT课件主要包含了刻度线,玻璃棒,mL容量瓶,胶头滴管,凹液面最低处,无影响等内容,欢迎下载使用。









