




所属成套资源:2021化学人教版(2019) 一轮复习 课件+学案
- 第2讲 物质的量浓度及一定物质的量浓度溶液的配制学案 学案 0 次下载
- 微专题1 阿伏加德罗常数的判断学案 学案 1 次下载
- 第3讲 氧化还原反应课件PPT 课件 1 次下载
- 微专题2 高考中氧化还原反应方程式书写的解题策略课件PPT 课件 2 次下载
- 第1讲 物质的组成及分类学案 学案 0 次下载
第2讲 离子反应课件PPT
展开
这是一份第2讲 离子反应课件PPT,共60页。
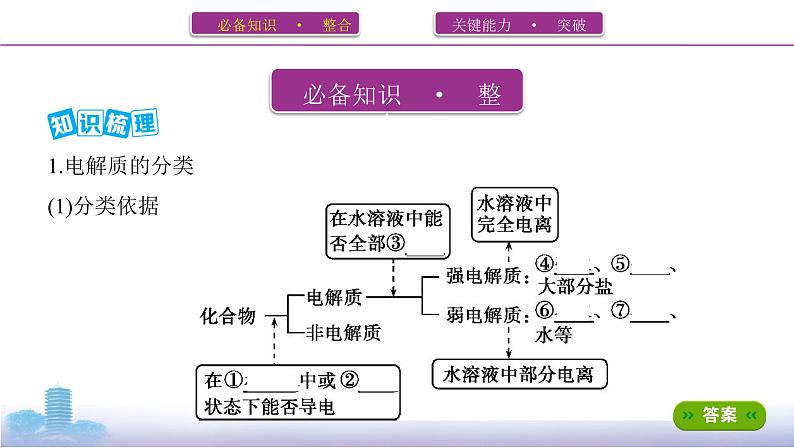
1.电解质的分类(1)分类依据
(2)电解质的强弱与物质类别的关系
思考1 NH3溶于水所得溶液能导电,NH3是否为电解质?
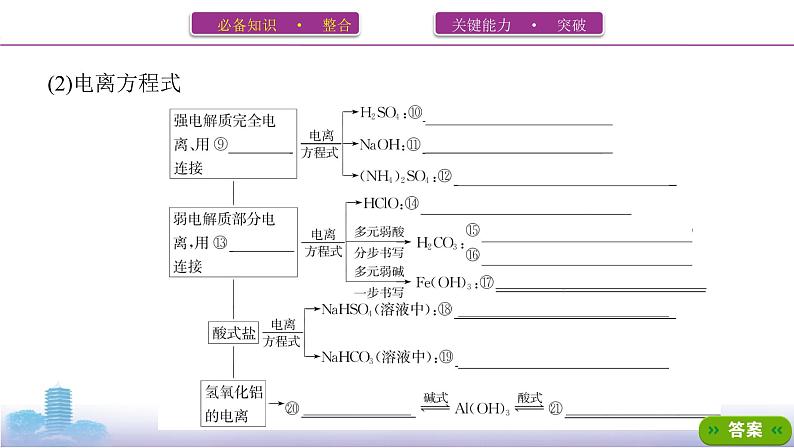
2.电解质的电离(1)电离电解质在水溶液中或熔融状态下,解离出⑧ 自由移动 的离子的过程。
思考2 写出下列物质的电离方程式:(1)CH3COOH CH3COO-+H+ 。(2)HF H++F- 。(3)KHCO3 K++HC 。(4)KHSO4(水溶液) K++H++S 。(5)KHSO4(熔融) K++HS 。
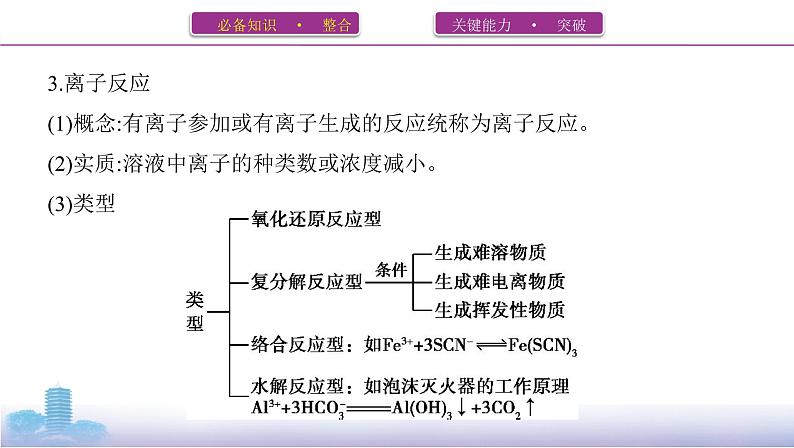
3.离子反应(1)概念:有离子参加或有离子生成的反应统称为离子反应。(2)实质:溶液中离子的种类数或浓度减小。(3)类型
4.离子方程式(1)定义:用实际参加反应的离子来表示反应的式子。(2)意义:离子方程式不仅可以表示某一个具体的化学反应,还可以表示 同一类型 的化学反应。
(3)书写步骤(以CaCO3与盐酸反应为例)
(4)离子方程式的意义(5)物质“拆分”原则书写离子方程式时,氧化物、过氧化物、弱电解质、多元弱酸的酸根离子、
沉淀、气体、非电解质均不能拆分,易电离的强电解质(强酸、强碱、大多数
可溶性盐)拆成离子形式。
1.易错易混辨析(正确的画“√”,错误的画“✕”)(1)氨水导电,液氨不导电,所以氨水是电解质 ( )(2)液氯不导电,氯水导电是因为氯气与水反应生成的电解质电离,故氯气是
非电解质 ( )(3)强电解质都是离子化合物,弱电解质都是共价化合物( )(4)HClO是弱酸,故NaClO是弱电解质 ( )(5)H2SO4是强电解质,故浓硫酸具有很强的导电性 ( )(6)盐酸的导电性一定强于醋酸溶液的导电性 ( )(7)NaCl溶液在电流的作用下电离出钠离子和氯离子 ( )
(8)有水生成的反应一定是离子反应 ( )(9)所有的化学反应都能写出离子方程式 ( )(10)H++OH- H2O只能表示强酸与强碱发生的复分解反应 ( )(11)向稀硝酸中滴加Na2SO3溶液:S +2H+ SO2↑+H2O ( )(12)H++OH- H2O可表示所有强酸和强碱的中和反应 ( )(13)向饱和H2S溶液中通入Cl2:H2S+Cl2 S↓+2H++2Cl- ( )
2.下列反应可用离子方程式“H++OH- H2O”表示的是( )A.NaHSO4溶液与Ba(OH)2溶液混合B.NH4Cl溶液与Ca(OH)2溶液混合C.HNO3溶液与KOH溶液混合D.Na2HPO4溶液与NaOH溶液混合
3.离子方程式的正误判断(正确的画“√”,错误的画“✕”)。(1)将Na投入CuSO4溶液中:2Na+Cu2+ 2Na++Cu ( )(2)Fe和稀盐酸反应:2Fe+6H+ 2Fe3++3H2↑ ( )(3)向CuSO4溶液中通入H2S气体:Cu2++S2- CuS↓ ( )(4)氯气溶于水:Cl2+H2O 2H++Cl-+ClO- ( )(5)锌片插入硝酸银溶液中:Zn+Ag+ Zn2++Ag ( )(6)向FeCl2溶液中通入Cl2:Fe2++Cl2 Fe3++2Cl- ( )
解析 (1)Na先与水反应,不会置换出Cu。(2)盐酸将Fe氧化为Fe2+。(3)H2S是弱电解质,不能拆成离子形式。(4)HClO是弱电解质,不能拆成离子形式。(5)电荷不守恒。(6)电荷不守恒。
考点一 电解质的电离题组一 电解质的理解及判断
1.下列关于电解质说法正确的是 ( )A.能导电的物质叫电解质B.NaCl晶体不导电,所以NaCl不是电解质C.熔融的KOH导电,所以KOH是电解质D.电解质在通电时发生电离
解析 在水溶液里或熔融状态下能导电的化合物是电解质,能导电的物
质不一定是电解质,如金属单质能导电,但金属单质不是化合物,所以不是电
解质也不是非电解质,选项A错误;氯化钠晶体中不含自由移动的离子,不导
电,但氯化钠在水溶液中或熔融状态下能导电,氯化钠是电解质,选项B错误;
熔融态的氢氧化钾能电离出自由移动的离子,能导电,氢氧化钾是电解质,选
项C正确;电解质在水溶液里或熔融状态下发生电离,不是在通电条件下发生
电离,选项D错误。
2.(2021江西南昌新建一中月考)下列关于纯净物、混合物、电解质、非电解
质的正确组合为 ( )
解析 冰水混合物为纯净物,A错误;蒸馏水为纯净物,蔗糖溶液为蔗糖和
水的混合物,氧化铝为电解质,二氧化硫为非电解质,B正确;盐酸是混合物,不
是电解质,铜是单质,既不是电解质也不是非电解质,C错误;石墨是单质,既不
是电解质也不是非电解质,D错误。
方法规律判断物质是否是电解质(或强、弱电解质)的思路
题组二 电离方程式的书写
3.下列电离方程式正确的是 ( )A.NaOH电离方程式:NaOH Na++H++O2-B.硫酸铝的电离方程式:Al2(SO4)3 A +(SO4 C.NaCl的电离方程式:NaCl Na++Cl-D.硫酸氢铵电离方程式:NH4HSO4 N +H++S
4.下列电离方程式不正确的是 ( )A.AlCl3在溶液中的电离方程式为AlCl3 Al3++Cl-B.CaCl2在溶液中的电离方程式为CaCl2 Ca2++2Cl-C.NaHSO4在熔融状态下的电离方程式为NaHSO4(熔融) Na++HS D.CH3COONH4的电离方程式为CH3COONH4 N +CH3COO-
解析 AlCl3是盐,在溶液中完全电离出铝离子和氯离子,电离方程式为
AlCl3 Al3++3Cl-,故A错误;CaCl2是盐,在溶液中完全电离出钙离子和氯离子,电离方程式为CaCl2 Ca2++2Cl-,故B正确;NaHSO4是盐,在熔融状态下电离出钠离子和硫酸氢根离子,电离方程式为NaHSO4(熔融) Na++HS ,故C正确;CH3COONH4是盐,在溶液中完全电离出铵根离子和醋酸根离子,电离
方程式为CH3COONH4 N +CH3COO-,故D正确。
题组三 导电性强弱的判断及理解5.同一温度下,强电解质溶液a、弱电解质溶液b、金属导体c,三者的导电能
力相同,升高温度后,它们的导电能力强弱顺序是 ( )A.b>a>c B.a=b=c C.c>a>b D.b>c>a
解析 金属导体随温度升高导电能力减弱;强电解质在溶液中不存在电
离平衡,升高温度,溶液中的离子浓度不变,离子运动加快导电能力增强;弱电
解质在溶液中存在着电离平衡,升高温度,弱电解质的电离程度增大,溶液中
的离子浓度增大,溶液的导电能力增强。
6.向澄清石灰水中不断通入二氧化碳气体的过程中,该溶液的导电性的变化
是(纵坐标表示导电性,横坐标表示二氧化碳气体的体积) ( )
解析 根据题意知,不断通入CO2,发生的化学反应为①Ca(OH)2+CO2 CaCO3↓+H2O,②CaCO3+CO2+H2O Ca(HCO3)2;当CO2不足量或恰好反应时,发生的反应是①,碳酸钙是沉淀,水是弱电解质,随着反应的进行溶液中离
子浓度逐渐减小,导电能力逐渐减弱;当继续通入过量的二氧化碳时发生的反
应是②,生成的碳酸氢钙是强电解质,易溶于水,能电离出自由移动的离子,溶
液中离子浓度逐渐增大,导电能力逐渐增强。
方法规律金属导电与电解质溶液导电的原因(1)金属能导电是因为在电场作用下自由电子定向移动,温度升高,金属导电
性变弱。(2)电解质溶液能导电是因为溶液中有自由移动的离子。电解质溶液导电能
力的强弱取决于溶液中自由移动离子的浓度和离子所带的电荷数,和电解质
的强弱没有必然联系。对于弱电解质溶液,温度升高时,弱电解质电离程度增
大,离子浓度增大,导电性会增强。
考点二 离子方程式的书写及正误判断
核心整合(1)总体思路
①“一查”是否符合客观事实。如2Fe+6H+ 2Fe3++3H2↑(✕),因H+不能把Fe氧化成Fe3+。②“二查”“ ”“ ”“↑”“↓”使用是否恰当。如用饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3↓+3H+(✕),因Fe(OH)3胶体不是沉淀,不能标“↓”。③“三查”拆分是否正确。只有易溶于水的强电解质能拆写成离子,其他物质均不能拆写。如Ca(HCO3)2+2H+ Ca2++2CO2↑+2H2O(✕),因未将Ca(HCO3)2拆分成Ca2+和HC 。
如Cl2+H2O 2H++Cl-+ClO-(✕),因将弱酸HClO拆分成了H+和ClO-。④“四查”是否漏写离子反应。如稀硫酸与氢氧化钡溶液反应:Ba2++S BaSO4↓(✕),因忽略氢离子和氢氧根离子的反应。⑤“五查”反应物的“量”——过量、少量、足量等。如把过量的NaHCO3溶液与Ca(OH)2溶液混合:HC +Ca2++OH- CaCO3↓+H2O(✕),因未考虑反应物中量的关系。⑥“六查”是否符合质量守恒和电荷守恒。a.质量守恒。
如Na+H2O Na++OH-+H2↑(✕),因反应前后氢原子的数目不相等。b.电荷守恒。如Fe3++Cu Fe2++Cu2+(✕),因电荷不守恒。
注意 得失电子守恒:氧化还原反应型的离子方程式还要符合得失电子守恒。如将氯化亚铁溶液和稀硝酸混合:Fe2++4H++N Fe3++2H2O+NO↑(✕),因氧化剂得到的电子总数和还原剂失去的电子总数不相等。
例 (2020浙江7月选考,13,2分)能正确表示下列反应的离子方程式是 ( )A.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:S +Ba2+ BaSO4↓B.电解MgCl2水溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑C.乙酸乙酯与NaOH溶液共热:CH3COOCH2CH3+OH- CH3COO-+CH3CH2OHD.CuSO4溶液中滴加稀氨水:Cu2++2OH- Cu(OH)2↓
解析 Ba(OH)2中的OH-还会与(NH4)2Fe(SO4)2中的Fe2+反应,正确的离子方
程式为Ba2++2OH-+Fe2++S BaSO4↓+Fe(OH)2↓,A项不正确;Mg2+会与电解生成的OH-反应,生成Mg(OH)2沉淀,B项不正确;乙酸乙酯、乙醇为有机
物,是非电解质,不可拆分,C项正确;NH3·H2O为弱电解质,不能拆分,D项不正
确。
题组训练题组一 离子方程式的正误判断
1.(2021福建福州第四中学月考)下列离子方程式书写正确的是 ( )A.大理石与盐酸反应:C +2H+ H2O+CO2↑B.氢氧化铝固体与盐酸反应:H++OH- H2OC.氯化镁溶液中滴入氢氧化钠溶液:MgCl2+2OH- Mg(OH)2↓+2Cl-D.氯化钡溶液中滴入硫酸钠溶液:Ba2++S BaSO4↓
解析 大理石主要成分是碳酸钙,碳酸钙与盐酸反应的离子方程式为
CaCO3+2H+ Ca2++H2O+CO2↑,A错误;氢氧化铝固体与盐酸反应的离子方程式为3H++Al(OH)3 3H2O+Al3+,B错误;氯化镁是易溶于水的强电解质,故向其溶液中滴入氢氧化钠溶液,反应的离子方程式为Mg2++2OH- Mg(OH)2↓,C错误;氯化钡溶液中滴入硫酸钠溶液生成BaSO4沉淀和NaCl,故离子方程
式为Ba2++S BaSO4↓,D正确。
2.下列离子方程式书写正确的是 ( )A.大理石与醋酸反应:C +2CH3COOH 2CH3COO-+H2O+CO2↑B.澄清石灰水与碳酸钠溶液反应:Ca(OH)2+C CaCO3↓+2OH-C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+ 2Fe3++2H2OD.稀硫酸和氢氧化钡溶液反应:H++S +Ba2++OH- BaSO4↓+H2O
解析 大理石主要成分为碳酸钙,与醋酸发生反应的离子方程式为CaCO3+2CH3COOH 2CH3COO-+Ca2++H2O+CO2↑,故A错误;澄清石灰水为氢氧化钙溶液,可拆,与碳酸钠溶液反应的离子方程式为Ca2++C CaCO3↓,故B错误;Fe2+与H2O2在酸性溶液中反应生成三价铁离子和水,离子方程式为2Fe2++H2O2+2H+ 2Fe3++2H2O,故C正确;稀硫酸和氢氧化钡溶液反应的离子方程式为2H++S +Ba2++2OH- BaSO4↓+2H2O,故D错误。
题组二 与量有关的离子方程式的书写3.(2020课标Ⅲ,11,6分)对于下列实验,能正确描述其反应的离子方程式是 ( )A.用Na2SO3溶液吸收少量Cl2:3S +Cl2+H2O 2HS +2Cl-+S B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2 CaCO3↓+2H+C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2 O2↑+2H++2Fe2+D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:N +OH- NH3·H2O
解析 设少量Cl2为1 ml,根据得失电子守恒可知,1 ml Cl2消耗1 ml S :Cl2+S +H2O 2Cl-+S +2H+,由于S 过量,继续消耗产生的H+生成HS ,故总反应的离子方程式为3S +Cl2+H2O 2HS +2Cl-+S ,A项正确;将离子方程式写为化学方程式,可知是H2CO3制得HCl,不符合强酸制弱
酸规律,B项错误;加入的少量Fe3+对H2O2的分解起催化作用,催化机理为2Fe3++
H2O2 O2↑+2H++2Fe2+和H2O2+2Fe2++2H+ 2Fe3++2H2O,C项错误;由电离方程式NH4HSO4 N +H++S 可知,OH-先与H+反应,再与N 反应,故同浓度同体积两种溶液混合,发生的反应为H++OH- H2O,D项错误。
4.小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。(1)少量SO2通入Ba(OH)2溶液中的离子方程式为 SO2+Ba2++2OH- BaSO3↓+H2O ,过量的SO2通入Ba(OH)2溶液中的离子方程式为 SO2+OH-
HS 。(2)小刚同学将SO2通入BaCl2溶液中,出现了异常现象,看到了明显的白色沉
淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液 白色沉淀 观察现象,并判断则操作①的名称为 过滤 ,试剂A的化学式为 HCl 。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是
BaSO4 (填化学式),产生该白色沉淀的离子方程式是 2SO2+2Ba2++O2+2H2O 2BaSO4↓+4H+ 。
解析 (1)少量SO2通入Ba(OH)2溶液时生成正盐,过量SO2通入Ba(OH)2溶液时
生成酸式盐,故离子方程式分别为Ba2++SO2+2OH- BaSO3↓+H2O、SO2+OH- HS 。(2)实现不溶性固体和液体的分离可以采用过滤的方法,将SO2通入BaCl2溶液中,出现的白色沉淀可能是硫酸钡、亚硫酸钡或二者都有,
硫酸钡和盐酸不反应,但是亚硫酸钡可以和盐酸反应,可以用盐酸来鉴别沉淀
的成分。(3)硫酸钡和盐酸不反应,但是亚硫酸钡可以和盐酸反应,所以不溶
于盐酸的白色沉淀物是BaSO4,BaSO4沉淀的生成和亚硫酸根离子的不稳定性
有关,空气中的氧气将亚硫酸根离子氧化为S ,最终与Ba2+反应生成硫酸钡,即2SO2+2Ba2++O2+2H2O 2BaSO4↓+4H+。
1.离子共存判断的“三大步骤”第一步:“细审题干关键点”(1)注意“一定大量共存”“可能大量共存”“不能大量共存”“因发生氧
化还原反应而不能大量共存”等关键点。(2)注意“透明溶液”意味着无难溶物和微溶物,但并不意味着溶液无色。第二步:“分析限制条件”(1)常见表示溶液呈酸性的表述a.常温下,pH=1的溶液;b.使pH试纸变红的溶液;
c.使甲基橙呈红色的溶液;d.与镁粉反应放出氢气的溶液;e.常温下,c(OH-)=1×10-14 ml·L-1的溶液或c(OH-)/c(H+)
相关课件
这是一份人教版 (2019)必修 第一册第二节 离子反应完美版课件ppt,共60页。PPT课件主要包含了第二节离子反应,研习一电解质,自读教材,要点归纳,题组训练,研习三离子反应等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习第2章化学物质及其变化第2讲离子反应课件
这是一份2023届高三化学高考备考一轮复习第2讲 离子反应课件,共56页。PPT课件主要包含了第2讲离子反应,⊙考点分析,续上表,答案⑥,答案A,考点三离子共存,考点四离子的检验,答案D等内容,欢迎下载使用。









