




- 第2讲 离子反应课件PPT 课件 0 次下载
- 第3讲 氧化还原反应课件PPT 课件 1 次下载
- 第1讲 物质的组成及分类学案 学案 0 次下载
- 第2讲 离子反应学案 学案 0 次下载
- 第3讲 氧化还原反应学案 学案 0 次下载
微专题2 高考中氧化还原反应方程式书写的解题策略课件PPT
展开微专题2 高考中氧化还原反应方程式书写的解题策略 近几年高考化学(无论是新课标高考还是新课改高考)中,无论是化学方 程式的书写,还是离子方程式的书写,都关于氧化还原反应。在选择题的离子 方程式书写、正误判断及填空题的工艺流程题、化学实验题、化学反应原 理题中都有呈现。新情境下有关方程式书写的试题能很好地落实考纲要求 对学生接受、吸收、整合化学信息能力的掌握和解决化学问题的能力及化 学学科核心素养的考查。此类问题主要考查考生对氧化还原反应、离子反 应、电化学等基本概念和原理的应用能力,此类题型要求学生能够从信息中 提炼出新的知识,并结合已学知识,合理应用新信息进行推理,通过类比、迁移解决此类方程式书写的问题。
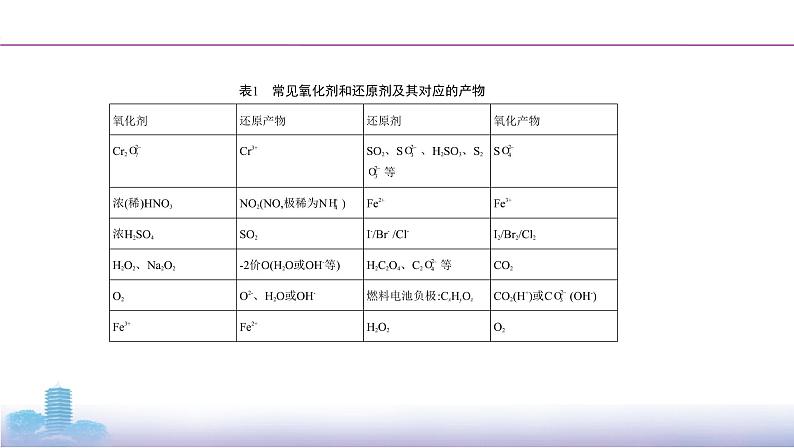
表1 常见氧化剂和还原剂及其对应的产物
表2 放电(氧化性、还原性强弱)顺序表
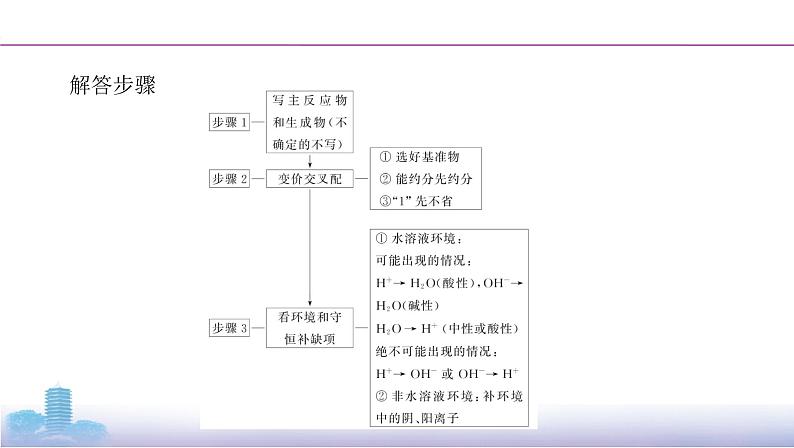
第1步:根据题中文字或流程图等信息和价态变化规律写出两剂两产物:氧化 剂+还原剂 氧化产物+还原产物。即“写主反应物和生成物”。第2步:根据得失电子守恒写出两剂两产物的化学计量数,即“变价交叉配”。第3步:根据电荷守恒、原子守恒及反应环境在方程式两边添加H+、OH-、H2O或其他小分子、离子,使方程式两边满足电荷守恒、原子守恒,即“看环境 和守恒补缺项”。在书写过程中还要有四个本能反应:判断化合价的本能反应;注意反应环境的 本能反应;考虑共存与否的本能反应;分析定量关系的本能反应。
例1 Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时, 取50.00 mL葡萄酒样品,用0.010 00 ml·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为 S2 +2I2+3H2O 2S +4I-+6H+ 。
题后反思 本题属于文字信息题型。文字信息题中生成物的确定方法为:寻找题中 直接或间接提示的生成物信息;依据价态变化规律(需熟记两表)推测可能的 生成物;当推测生成物有多种可能时,务必联系所学知识及题中信息进行仔细 斟酌,排除后确定。
例2 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇 和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜 (主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工 艺流程如图所示:
写出步骤③中主要反应的离子方程式: 2Cu2++S +2Cl-+H2O 2CuCl↓ +S +2H+ 。
题后反思 工艺流程题中反应物和生成物的确定方法为仔细阅读题干和流程图信 息,通过关键词定位,有针对性地寻找;顺应箭头指向追根溯源,一般箭头从反 应物指向生成物;分析各元素的变化,特别是核心元素的价态变化并进行综合 判断。
例3 最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中 CO2和H2S的高效去除。示意图如下图所示。
其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:①EDTA-Fe2+-e- EDTA-Fe3+②2EDTA-Fe3++H2S 2H++S+2EDTA-Fe2+写出该装置工作时,阴极的电极反应 CO2+2H++2e- CO+H2O ,协同转 化总反应为 CO2+H2S CO+H2O+S 。
解析 CO2在ZnO@石墨烯电极上得电子转化为CO,则该电极为阴极,石墨烯 电极为阳极。结合题中所给酸性环境(质子交换膜),阴极的电极反应式为CO2 +2H++2e- CO+H2O,将石墨烯电极区反应①、②与阴极反应相加得协同转化总反应:CO2+H2S CO+H2O+S。
题后反思电化学题中反应物和生成物的确定方法为:(1)三看。一看池,看清装置是原电池还是电解池;二看极,看清电极材料及其 附近所通入的物质;三看液,看清电解质溶液,看清箭头指向(一般指入为反应 物,指出为生成物),看清阴、阳离子移动的方向。(2)两想。一想工作原理,原电池负极失电子化合价升高,正极得电子化合价 降低,阴、阳离子移动的方向为阳正、阴负;电解池阳极失电子化合价升高, 阴极得电子化合价降低,阴、阳离子移动的方向为阳阴、阴阳;二想放电顺 序,原电池中负极为强还原性物质失电子,正极为强氧化性物质得电子,电解池中阳极为还原性强的物质先失电子,阴极为氧化性强的物质先得电子。
1.(2020天津,13节选)Fe、C、Ni是三种重要的金属元素。回答下列问题:(3)Fe、C、Ni能与Cl2反应,其中C和Ni均生成二氯化物,由此推断FeCl3、 CCl3和Cl2的氧化性由强到弱的顺序为 CCl3>Cl2>FeCl3 ,C(OH)3与盐酸 反应有黄绿色气体生成,写出反应的离子方程式: 2C(OH)3+6H++2Cl- 2C2++Cl2↑+6H2O 。(4)由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3 的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方 式为 少量多次 (填“一次过量”或“少量多次”),此法制备NiSO4的化学 方程式为 3Ni+3H2SO4+2HNO3 3NiSO4+2NO↑+4H2O 。
解析 (3)C与Cl2反应生成二氯化物,可知氧化性:CCl3>Cl2>CCl2,Fe与Cl2反 应生成三氯化铁,可知氧化性:Cl2>FeCl3,故氧化性:CCl3>Cl2>FeCl3;C(OH)3 与盐酸反应生成的黄绿色气体为Cl2,即氯离子被C(OH)3氧化为Cl2,C(OH)3 被还原为C2+,据得失电子守恒、电荷守恒、原子守恒可得离子方程式:2C(OH)3+6H++2Cl- 2C2++Cl2↑+6H2O。(4)为了防止Ni2+被HNO3氧化为Ni3+,应多次加入少量HNO3,涉及的化学方程式 为3Ni+3H2SO4+2HNO3 3NiSO4+2NO↑+4H2O
2.(2020课标Ⅰ,26节选)钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的 化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程 可由黏土钒矿制备NH4VO3。 回答下列问题:“酸浸氧化”中,VO+和VO2+被氧化成V ,同时还有Fe2+离子被氧化。写出VO+转化为V 反应的离子方程式VO++MnO2+2H+ V +Mn2++H2O。
解析 Fe3O4与硫酸反应生成Fe2+和Fe3+,Fe2+能够被氧化为Fe3+;VO+中钒元素化 合价为+3,V 中钒元素化合价为+5,VO+被MnO2氧化为V ,MnO2被还原为Mn2+,结合得失电子守恒、原子守恒和电荷守恒配平:VO++MnO2+2H+ V+Mn2++H2O。
3.电解碳酸钠溶液,原理如图所示: 阳极的电极反应式为 2H2O-4e-+4C O2↑+4HC 。
苏教版 (2019)选择性必修1第一单元 化学反应的热效应优质ppt课件: 这是一份苏教版 (2019)选择性必修1第一单元 化学反应的热效应优质ppt课件,共20页。PPT课件主要包含了NaBH4s,题型3根据能量图像,题型4根据盖斯定律,C石墨s等内容,欢迎下载使用。
高考化学二轮复习课件必考题创新突破2新情境下化学(离子)方程式书写的解题策略(含解析): 这是一份高考化学二轮复习课件必考题创新突破2新情境下化学(离子)方程式书写的解题策略(含解析),共23页。
热考题型特训2 信息型氧化还原反应方程式的书写课件PPT: 这是一份热考题型特训2 信息型氧化还原反应方程式的书写课件PPT,共27页。












