




科粤版第八章 常见的酸、碱、盐8.3 酸和碱的反应图片ppt课件
展开农业和工业上常用熟石灰来改良酸性土壤和处理酸性废水,你知道其中的原理吗?
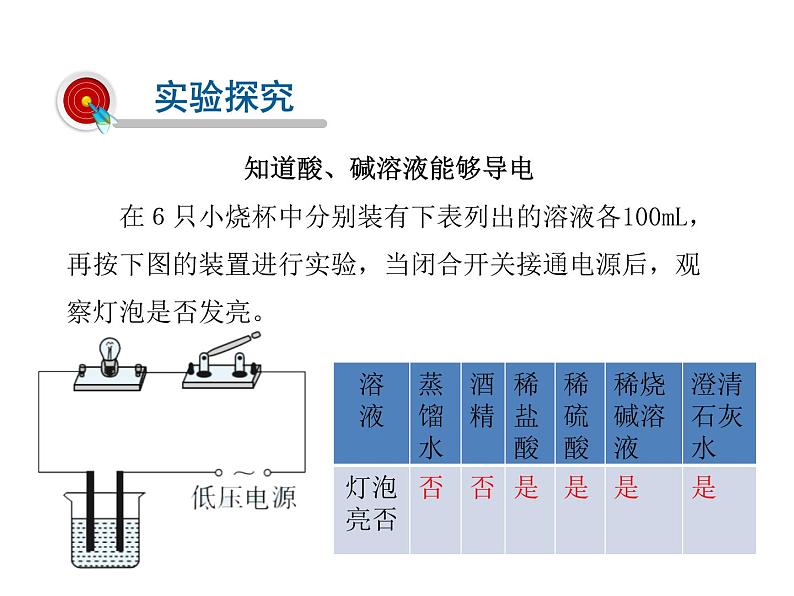
在6只小烧杯中分别装有下表列出的溶液各100mL,再按下图的装置进行实验,当闭合开关接通电源后,观察灯泡是否发亮。
知道酸、碱溶液能够导电
1.为什么蒸馏水、酒精不能使灯泡发亮,而酸溶液和碱溶液可以呢?
这说明,蒸馏水、酒精不导电,而酸溶液和碱溶液能够导电。这说明酸、碱溶液中存在带电的粒子。
2.酸、碱溶液可以导电是因为酸、碱溶液中存在带电的粒子,这些带电的粒子是什么?
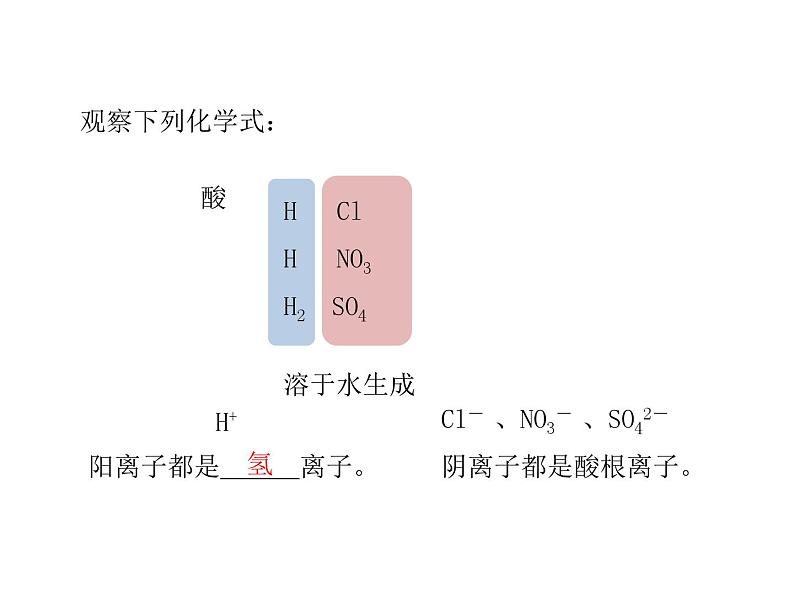
H ClH NO3H2 SO4
Cl- 、NO3- 、SO42-
阳离子都是___离子。
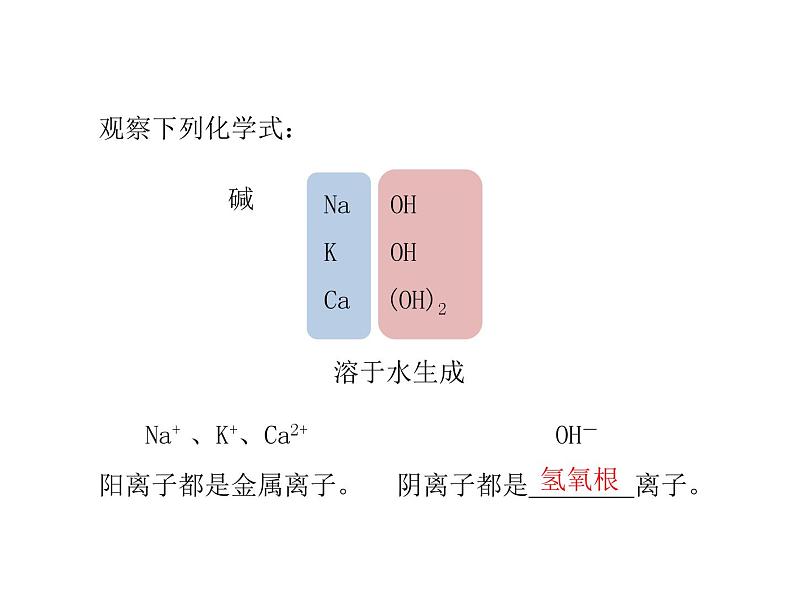
Na OHK OHCa (OH)2
Na+ 、K+、Ca2+
阴离子都是____离子。
酸和碱溶于水生成的产物中都各自有其相同的一种离子,在酸溶液中是氢离子,在碱溶液中是氢氧根离子。 这也是它们会各自有相似化学性质的原因。
1.取3mL稀氢氧化钠溶液于试管中,逐滴加入稀盐酸,观察到什么现象?有没有反应发生?
实验现象:无明显实验现象。
2.为了观察到上述两种溶液发生反应的现象,应采取什么措施?
1.在氢氧化钠溶液中滴加无色酚酞,此时溶液是红色;2.再向其中逐渐加入稀盐酸;3.观察到瞬间红色变无色,证明两种溶液发生了反应。
1.用玻璃棒沾上述氢氧化钠溶液与稀盐酸刚好反应生成的溶液,在酒精灯火焰上方加热烘干,有何现象?说明什么?
有固体析出。说明两种溶液反应生成了新的物质。
2.假如实验步骤是先放稀盐酸,再放氢氧化钠,实验现象会有所不同吗?
不会有什么不同。但现象取决于加入的指示剂,如果用酚酞,溶液由无色变红色;如果用紫色石蕊试剂,颜色由红色变蓝色。
HCl + NaOH —— NaCl + H2O
3.观察上述实验后,你能写出盐酸和氢氧化钠的表达式吗?根据这个规律,你能猜到盐酸和氢氧化钾的反应式吗?
(酸) (碱) (盐) (水)
HCl + KOH —— KCl + H2O
中和反应: 酸跟碱生成盐和水的反应。酸跟碱发生中和反应,同样是酸和碱重要的化学性质之一。
化学方程式: NaOH + HCl = NaCl + H2O中和反应的实质: OH- + H+ = H2O
复分解反应: 上表中,酸和碱性质的许多变化中都有这样的特点:参加反应的两种化合物互相交换成分生成另外两种化合物。 像这类由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
1.若用AB和CD分别表示两种化合物,如何表示复分解反应的通式?
AB + CD AD + CB
2.中和反应和复分解反应两者有什么关系? 为什么?
复分解反应包括中和反应,中和反应一定是复分解反应,但复分解反应不一定是中和反应。 例如:Fe2O3 + 6HCl == 2FeCl3 + 3H2O是复分解反应,但不是中和反应。
3.请归纳化合、分解、置换、复分解等各种基本反应类型的特点。
化合反应:由两种或两种以上的物质生成另一种物质的反应;分解反应:由一种物质生成两种或两种以上的物质的反应;
置换反应:由一种单质和一种化合物生成另一种单质和另一种化合物的反应;复分解反应:由两种化合物相互交换成分生成另外两种化合物的反应。
1.改良酸性或碱性的土壤2.废水处理3.医药应用4.调节溶液的酸碱性
1.改良酸性或碱性的土壤
夏天到农村去,常常看到养鱼的农户向放干的鱼塘底撒熟石灰,这是为了中和鱼塘底泥中过多的有机酸 (同时达到杀菌消毒的目的) 使鱼塘水达到适合鱼苗生长的pH。
如果废水中含有酸性物质 (如硫酸、盐酸) 我们必须先用碱性物质 (如烧碱、熟石灰) 将其中和成中性以后才能排放,否则会造成水体污染。
如果你被蚊虫叮咬,皮肤会出现红肿而疼痛。这是因为它们向你的皮肤“注射”了“蚁酸”——甲酸。这时可以涂抹弱碱性的肥皂水、 小苏打水、稀氨水或清凉油以减轻疼痛。
在科学实验中,经常需要将溶液的pH控制在某一特定范围。当溶液的酸性或碱性太强或太弱时,可以加适当的碱或酸进行调节。
部分非金属氧化物能跟水化合生成酸,例如: SO2 + H2O —— H2SO3 (亚硫酸) SO3 + H2O —— H2SO4
煤和石油燃烧后所产生的烟气中,含有二氧化硫和氮氧化物,排放到空气中被云层吸收,并经过化学作用形成酸雾,随同雨水下降便成为显酸性的雨水。 若其pH小于5.6,称为酸雨,酸雨的危害性很大。如影响人类健康;使森林大面积枯死;使湖水酸化,鱼类死亡;使农作物生长受到影响而减产;使名胜古迹,建筑物腐蚀损坏等。
1.酸和碱溶于水生成的产物中都各自有其相同的一种离子,在酸溶液中是氢离子,在碱溶液中是氢氧根离子。 2.中和反应:酸跟碱生成盐和水的反应。 3.基本反应类型:化合反应、分解反应、复分解反应和置换反应。 4.中和反应的应用:改良酸性或碱性的土壤、废水处理、医药应用和调节溶液的酸碱性。
1.下列各组物质间的反应,要借助酸碱指示剂才能判断出反应发生的是( ) A.锌与稀盐酸 B.烧碱与稀硫酸 C.氧化铁与稀硫酸 D.硫酸铜溶液与氢氧化钠溶液
2.中和反应在生产和生活中有广泛的应用,下列应用与中和反应原理无关的是 ( ) A.施用熟石灰改良酸性土壤 B.服用含Al(OH)3的药物治疗胃酸过多 C.用熟石灰和硫酸铜制波尔多液 D.用NaOH溶液洗涤石油产品中的残余硫酸
3.向盛有酚酞和NaOH溶液的烧杯中滴加稀硫酸,直至液体呈无色,为探究反应后溶液中溶质的组成,所选试剂不正确的是 ( ) A.稀盐酸 B.锌粒 C.碳酸钠溶液 D.紫色石蕊溶液
4.某镇硫酸厂排出的废气中含有SO2,废水中含有H2SO4。请回答:(1) 用熟石灰处理该厂废气和废水的化学方程式为: _________________________________________(2) 该厂的下列整治措施不妥的是______ A.废气循环利用 B.将废气点燃后排放 C.废水用碱中和后排 D.改进工艺,减少废气、废水产生
Ca(OH)2+H2SO4═CaSO4+2H2O
5.有胃病的人常常胃酸过多,可以口服_____以中和胃中过多的胃酸 (主要是HCl溶液)。
A. Al(OH)3 B. H2SO4C. NaOH D. Na2CO3
化学九年级下册8.3 酸和碱的反应集体备课课件ppt: 这是一份化学九年级下册<a href="/hx/tb_c94345_t3/?tag_id=26" target="_blank">8.3 酸和碱的反应集体备课课件ppt</a>,共23页。PPT课件主要包含了新课导入,溶液的导电性,酸与碱的中和反应,步骤与现象,解释与结论,不变色,非金属,中和反应的应用,改良酸性或碱性的土壤,废水处理等内容,欢迎下载使用。
初中化学科粤版九年级下册8.3 酸和碱的反应授课课件ppt: 这是一份初中化学科粤版九年级下册<a href="/hx/tb_c94345_t3/?tag_id=26" target="_blank">8.3 酸和碱的反应授课课件ppt</a>,共24页。PPT课件主要包含了学习目标,新知学习,溶于水生成,OH-,阳离子都是___离子,阴离子都是酸根离子,阳离子都是金属离子,氢氧根,中和反应,酸碱发生的反应等内容,欢迎下载使用。
2021学年8.3 酸和碱的反应图文ppt课件: 这是一份2021学年8.3 酸和碱的反应图文ppt课件,文件包含83酸和碱的反应ppt、83酸和碱的反应教案doc、溶液导电性mp4、酸碱中和mp4等4份课件配套教学资源,其中PPT共23页, 欢迎下载使用。













