





- 1.2.3 原子结构与元素的性质 第二课时课件PPT 课件 4 次下载
- 2.1.1 共价键 第一课时课件PPT 课件 3 次下载
- 2.2.1 分子的空间结构 第一课时 课件PPT 课件 6 次下载
- 1.1.2原子结构 第二课时 教案 教案 2 次下载
- 1.2.1 原子结构与元素周期律 第一课时 教案 教案 2 次下载
高中第二章 分子结构与性质第一节 共价键图文ppt课件
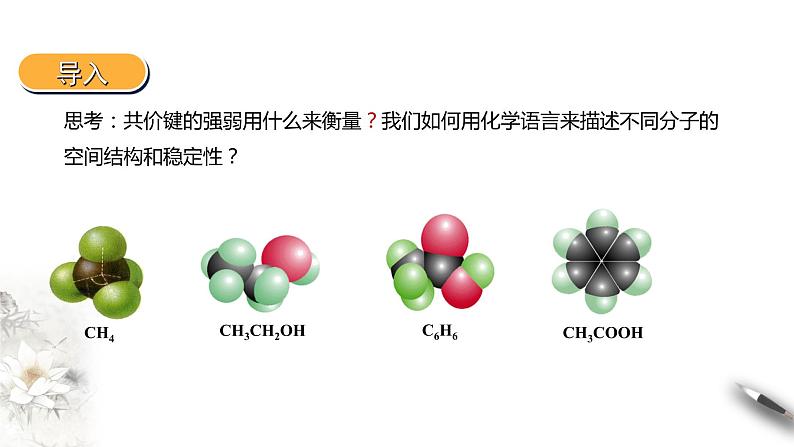
展开思考:共价键的强弱用什么来衡量?我们如何用化学语言来描述不同分子的空间结构和稳定性?
①键能是气态分子中断裂1 ml化学键解离成气态原子所吸收的能量。或气态基态原子形成1 ml化学键释放的最低能量。②键能通常取正值,单位是kJ/ml。③键能通常是298.15 K、101 kPa条件下的标准值。
一、键参数——键能、键长与键角
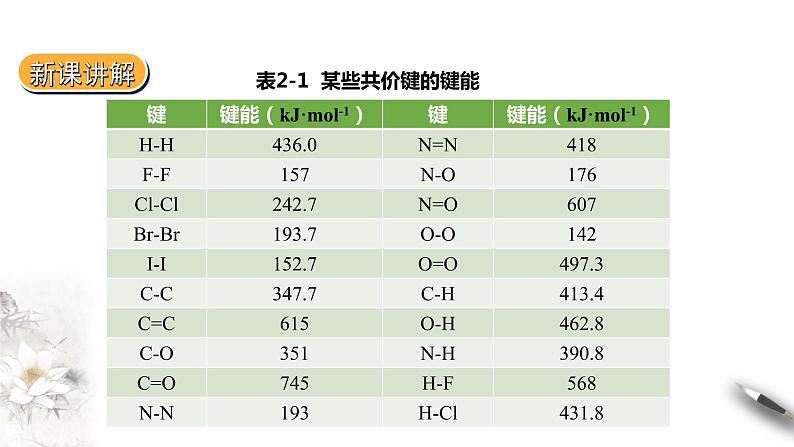
键能可通过实验测定,更多却是推算获得的。例如,断开CH4中的4个C—H,所需能量并不相等,因此,CH4中的C—H只能是平均值,而表2-1中的C—H键能是更多分子中的C—H键能的平均值。
键能可用于估算化学反应的热效应。某一化学反应是吸热反应还是放热反应?可以从键能数据表里查出相关化学键的键能,通过计算便可得知。如H—H键、F—F键、H—F键的键能分别为436 kJ·ml-1、157 kJ·ml-1、568 kJ·ml-1,则H2与F2反应是放热反应。
表2-1 某些共价键的键能
原子半径决定化学键的键长,原子半径越小,共价键的键长越短。
键长是衡量共价键强弱的另一个重要参数。简单地说,键长是构成化学键的两个原子的核间距。不过,分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。
化学键的键长与键能是相关的。例如,C—C键、C=C键、C≡C键的键长分别为154 pm、133 pm、120 pm,键长越来越小,它们的键能分别为347.7 kJ·ml-1、615 kJ·ml-1和812 kJ·ml-1,越来越大。共价键的键长越短,往往键能越大,表明共价键越稳定。
在多原子分子中,两个相邻共价键之间的夹角称为键角。
例如,三原子分子CO2的结构式为O=C=O,它的键角为180°,是一种直线型分子。 H2O分子中的H—O—H键角是105°,是一种V形(或称角形)分子。多原子分子中的键角一定,表明共价键具有方向性。
键长和键角的数值可以通过晶体的X射线衍射实验获得。
(1)判断共价键的稳定性:键能越大,断开化学键需要吸收的能量越多,化学键越稳定。
(2)判断分子的稳定性:结构相似的分子中,共价键的键能越大,分子越稳定。
(3)判断化学反应中的能量变化
在化学反应中,断裂旧化学键吸收能量,形成新化学键释放能量,因此反应焓变与键能的关系为ΔH=反应物键能总和-生成物键能总和。ΔH<0时,为放热反应;ΔH>0时,为吸热反应。
化学反应的反应热∆H=反应物键能总和 - 生成物键能总和
(1)试利用表2-1的数据进行计算,1mlH2分别与1mlCl2、 1mlBr2(蒸气)反应,分别形成2ml HCl和2ml HBr,哪一个反应释放的能量更多?如何用计算的结果说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?
通过计算1 ml H2与1 ml Cl2反应生成2 ml HCl时,放出184.9 kJ的热量;1 ml H2与1 ml Br2(蒸气)反应生成2 ml HBr时,放出102.3 kJ的热量。说明2 ml HBr分解需要吸收的能量比2 ml HCl低,故HBr更易分解。
H2 + Cl2 = 2HCl ΔH=436.0kJ·ml-1 + 242.7kJ·ml-1 -2×431.8kJ·ml-1 = -184.9kJ/ml
H2 + Br2 = 2HBr ΔH=436.0kJ·ml - 1 + 193.7kJ·ml - 1 -2×366kJ·ml - 1 = -102.3kJ/ml
(2) N2 、O2 、F2分别与H2的能力依次增强,从键能的角度应如何理解这一化学事实?
N2、O2、F2与H2的反应能力依次增强,其原因是N≡N键、O=O键、F—F键的键能依次为946 kJ·ml-1、497.3 kJ·ml-1、157 kJ·ml-1,键能越来越小,共价键越来越容易断裂。
(1)键长越小,一般键能越大,共价键越稳定,含该共价键的分子越稳定。
①根据成键原子的原子半径比较。同类型的共价键,成键原子的原子半径越小,键长越小。②根据共用电子对数比较,相同的两个原子间形成共价键时,单键键长>双键键长>三键键长。
相同原子的共价键键长的一半称为共价半径。
(3)通过上述例子,你认为键长、键能对分子的化学性质有什么影响?
键长越小,键能越大,分子的化学性质越不活泼。
①键长和键角决定分子的空间结构。
②常见分子中的键角与分子空间结构。
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1)只有非金属原子之间才能形成共价键( )(2)两个原子之间形成共价键时,至少有一个σ键( )(3)σ键和π键都只能存在于共价化合物中( )(4)双原子分子中,键长越短,分子越牢固 ( )
答案:× √ × √
2.从键长的角度判断,下列共价键中最稳定的是( )A.H—F B.N—H C.C—H D.S—H
3.能够用键能解释的是( )A.氮气的化学性质比氧气稳定B.常温常压下,溴呈液体,碘为固体C.稀有气体一般很难发生化学反应D.硝酸易挥发,硫酸难挥发
4.关于键长、键能和键角,下列说法不正确的是( )A.键角是描述分子空间结构的重要参数B.键长的大小与成键原子的半径和成键数目有关C.键能越大,键长越大,共价化合物越稳定D.键角的大小与键长、键能的大小无关
5.N—H键键能的含义是( )A.由N和H形成1 ml NH3所放出的能量B.把1 ml NH3中的共价键全部拆开所吸收的热量C.拆开约6.02×1023个N—H键所吸收的热量D.形成1个N—H键所放出的热量
6.有关碳和硅的共价键键能如下表所示:
简要分析和解释下列有关事实。(1)比较通常条件下,CH4和SiH4的稳定性强弱: 。 (2)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_________________________________________________________________。 (3)SiH4的稳定性小于CH4,硅更易生成氧化物,原因是 。
(2)C—C键和C—H键键能较大,所形成的烷烃较稳定,而硅烷中Si—Si键和Si—H键的键能较小,易断裂,导致长链硅烷难以生成
(3)C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
高中化学人教版 (2019)选择性必修2第二章 分子结构与性质第一节 共价键获奖ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第二章 分子结构与性质第一节 共价键获奖ppt课件,文件包含人教版化学选修二212《共价键》第二课时课件pptx、212共价键第二课时教案doc等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质教课内容ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质教课内容ppt课件,共57页。PPT课件主要包含了知识点一,共价键的极性,呈电中性,知识点二,随堂练学以致用,Cl2,C2H4,H2O2,课后测素养评价,CHO等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 共价键教学ppt课件: 这是一份人教版 (2019)选择性必修2第一节 共价键教学ppt课件,共60页。PPT课件主要包含了知识点一,共用电子对,非金属,知识点二,头碰头,轴对称,肩并肩,镜面对称,σ键与π键的比较,随堂练学以致用等内容,欢迎下载使用。













