




贵州省贵阳市2022年高考理综 化学模拟试题 06(含答案及解析)
展开【考前保密】
贵州省贵阳市2022年高考理综 化学模拟试题06
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Cl 35.5 Ca 40 Fe 56 Ni 59 Cu 64 Ba 137
一、选择题(本大题共7小题,每小题6分,共42分)
7.“中国名片”有中国航天、军事、天文等,这些领域的发展受到全世界瞩目,而这些领域与化学更有着密切的联系。下列说法不正确的是( )
A.“天宫二号”空间实验室的硅电池板将光能直接转换为电能
B.“蛟龙”号潜水器所使用的钛合金材料具有强度大、密度小、耐腐蚀等特性
C.5G技术的应用离不开光缆,我国光缆线路总长度超过了三千万千米,光缆的主要成分是晶体硅
D.港珠澳大桥设计使用寿命120年,水下钢柱镶锌块以利用牺牲阳极的阴极保护法防腐蚀
8.香豆素-3-羧酸是日用化学工业中的重要香料之一,它可以通过水杨醛经多步反应合成:
下列说法不正确的是( )
A.水杨醛与苯甲酸互为同分异构体
B.水杨醛、中间体、香豆素-3-羧酸都能使酸性高锰酸钾溶液褪色
C.中间体、香豆素-3-羧酸互为同系物
D.1mol香豆素-3-羧酸与NaOH溶液反应最多消耗3molNaOH
9.设 NA为阿伏加德罗常数的值。下列说法错误的是( )
A.27 g 铝加入足量 1 mol·L-1 的 NaOH 溶液,转移的电子数为 3NA
B.18 g 氨基(—ND2)中含有的电子数为 10NA
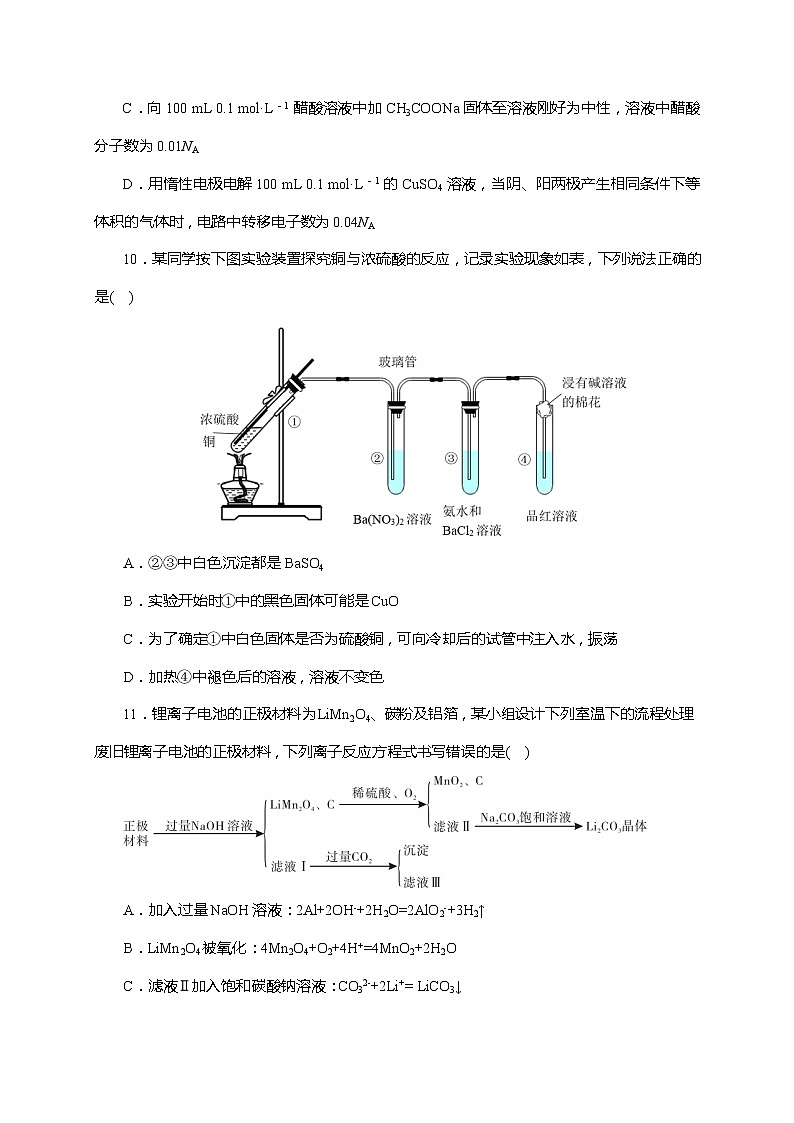
C.向 100 mL 0.1 mol·L-1 醋酸溶液中加 CH3COONa 固体至溶液刚好为中性,溶液中醋酸分子数为 0.01NA
D.用惰性电极电解 100 mL 0.1 mol·L-1 的 CuSO4 溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为 0.04NA
10.某同学按下图实验装置探究铜与浓硫酸的反应,记录实验现象如表,下列说法正确的是( )
A.②③中白色沉淀都是BaSO4
B.实验开始时①中的黑色固体可能是CuO
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.加热④中褪色后的溶液,溶液不变色
11.锂离子电池的正极材料为LiMn2O4、碳粉及铝箔,某小组设计下列室温下的流程处理废旧锂离子电池的正极材料,下列离子反应方程式书写错误的是( )
A.加入过量NaOH溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.LiMn2O4被氧化:4Mn2O4+O2+4H+=4MnO2+2H2O
C.滤液Ⅱ加入饱和碳酸钠溶液:CO32-+2Li+= LiCO3↓
D.滤液I加入过量CO2:CO2+OH-=HCO3-、2AlO2-+2H2O+ CO2=Al(OH)3↓+HCO3-
12.最近,中国科学家在《焦耳》杂志在线发表的一篇论文中首提“液态阳光”,即“太阳燃烧”,属于可再生绿色液态燃料。某模拟“人工树叶”的“液态阳光”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料异丙醇(CH3)2CHOH。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.a电极反应为3CO2+ 16H+- 18e-= (CH3)2CHOH + 4H2O
C.该装置工作时,H+从b极区向a极区迁移
D.异丙醇可发生氧化反应、还原反应、取代反应和聚合反应
13.主族元素W、X、Y、Z的原子序数依次增大且原子序数均不超过20,W、X同周期,W、Z的原子序数之和为28,它们组成的化合物Z(YW4)3X是一种制造磷肥的原料。下列说法错误的是( )
A.非金属性:X>W>Y B.ZW2中不含共价键
C.原子半径:Z>Y>W>X D.YX3分子中各原子最外层均达到8电子结构
二、非选择题(本大题共4小题,共58分)
(一)必做题
26.(14分) 某化学小组在实验室制备KMnO4,并利用其性质测定血液中钙的含量。请回答:
(一)KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步骤Ⅰ.将软锰矿(主要成分MnO2)和KOH固体混合后装入图所示装置A中,在空气中加热,并不断用B搅拌最终得到K2MnO4。
(1)仪器A、B分别是_______(填序号)。
A.瓷坩埚、玻璃棒B.石英坩埚、玻璃棒C.铁坩埚、玻璃棒D.铁坩埚、铁棒
(2)装置A处反应生成K2MnO4的化学方程式为_____________________。
步骤Ⅱ.KMnO4的制备。
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3 MnO42-+2H2O═2 MnO4-+MnO2↓+4OH﹣。
(3)甲同学利用Cl2在碱性条件下氧化K2MnO4制备KMnO4其装置如图所示(夹持和加热装置略)。
回答下列问题:
①装置B中的试剂为_____________________;若没有B装置则产率会_______(填“增大”“减小”或“不变”)。
②当C中反应结束后,后续操作是熄灭酒精灯,_______,拆除装置。
③请写出D中的生成物在生活中的一个应用:_______。
(4)乙同学利用已知信息和部分物质溶解度数据表,提出另一种新的制备方法:向上述K2MnO4溶液中加入_______(请从下列物质中选出一种最合适的物质),充分反应,然后过滤,再将滤液蒸发浓缩、降温结晶、过滤、洗涤、干燥,得KMnO4晶体。
物质 | KMnO4 | K2SO4 | CH3COOK | Na2SO4 |
20℃溶解度 | 6.4 | 11.1 | 217 | 30 |
A.亚硫酸氢钾 B.硫酸氢钠 C.稀盐酸 D.稀醋酸
(二)人体血液里Ca2+含量的测定。
抽取血样20.00mL,加适量的草酸铵[(NH4)2C2O4]溶液;可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用0.0020mol/L酸性KMnO4溶液滴定,共消耗9.00mL酸性KMnO4溶液。
(1)滴定时,当出现_____________________现象,即可确定反应达到终点。
(2)经过计算,血液样品中Ca2+的浓度为_______mg/cm3。
27.(14分) 铑(Rh)是铂系金属中的一种,其氧化态性质稳定且极难溶解而其氢氧化物是一种两性化合物,含铑催化剂化学工业中都有广泛的应用。以下是一种从废铑催化剂(杂质主要为有机杂质和少量Cu)中回收铑的工艺流程:
(1)焚烧的目的是________。
(2)实验室探究焚烧温度对铑回收率的影响,结果如图,当焚烧温度选择320℃时,回收效果最好,请解释选择此温度的可能的原因是:_________。
(3)用KHSO4熔融的目的是将焚烧后的铑和铜转化成可溶性的Rh2(SO4)3和CuSO4,写出铑和KHSO4反应的化学方程式_______________________________。
(4)用氨水除杂的原理是(用离子方程式和简要文字表述)_________,此步骤中,pH不能太高(实际调节pH在8左右)的原因是_______________________________。
(5)电解还原时,铑将在_____极(填“阳”或者“阴”)析出。
(6)铑的某配合物的化学式为CsRh(SO4)2,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为_____________________________。
28.(15分) 氮是生命体的重要组成元素,自然界中氮的循环对于生命活动有重要意义。
(1)一种利用锂及其化合物的循环,将空气中的N2转化为NH3的过程如图所示。
①X的化学式为___________。
②转化(Ⅲ)是电解熔融LiOH,该反应的化学方程式为___________。
(2)废水中氨氮(以NH3或NH4+形式存在)含量过高,直接排放会造成水体富营养化。用NaClO可以将氨氮氧化去除,已知NH3比NH4+更易被氧化。NaClO除去水中氨氮的反应过程如下:
NaClO+H2ONaOH+HClO
NH3+HClO=NH2Cl+H2O
2NH2Cl+HClO=N2↑+3HCl+H2O
①控制含氨氮废水的量和加入NaClO的量一定,测得反应相同时间,氨氮的去除率与溶液初始pH的关系如图-1所示。
(a)当pH<6时,氨氮去除率随溶液pH升高而升高的原因是:___________。
(b)当pH>10时,氨氮去除率随溶液pH升高而降低的原因是:___________。
②控制溶液的pH=7,测得反应相同时间,溶液中的氨氮、总氮(所有含氮微粒)的去除率随初始m(NaClO)∶m(NH3)的比例如图-2所示。当m(NaClO)∶m(NH3)>7.6,随m(NaClO)∶m(NH3)的增大,氨氮去除率始终接近100%,而总氮去除率逐渐降低的原因是___________。
③NaClO与NH3恰好完全反应时,反应的n(NaClO)∶n(NH3)的理论值是1.5.控制溶液的pH=7,测得反应相同时间,溶液中余氯含量与投入n(NaClO)∶n(NH3)的比值关系如图-3所示。水中的余氯的计算方法是向水中加入足量KI,生成的I2的物质的量看成是水中Cl2的物质的量。当n(NaClO)∶n(NH3)=1时,溶液中余氯含量较大的原因是___________。
(3)氨催化分解既可防治氨气污染,又能得到氢能源。在Co-Al催化剂体系中,压强p0下氨气以一定流速通过反应器得到不同催化剂下相同时间内NH3转化率随温度变化的关系如图-4所示。
图-4
使活化能最小的催化剂为_______;温度一定时,如果增大气体流速,则b点对应的点可能是____(填“a”“c”“d”“e”或“f”)。
(二)选做题
37.[化学——选修3:物质结构与性质](15分) Fe、Co、Ni、Cu、Ag是一系列合金的重要金属元素。
(1)Fe元素位于周期表的_______区,基态Fe2+与Fe3+离子中未成对电子数之比为_______。元素周期表中,铜、银位于同一副族相邻周期,则基态银原子的价层电子排布式为______________。
(2)将过量的NH3通入CuSO4溶液中可以得到Cu(NH3)4SO4,Cu(NH3)4SO4中第一电离能最大的是_______(填元素符号),NH3、CH4和H2O的沸点由高到低的顺序为______________。
(3)照相底片定影时,常用定影液硫代硫酸钠(Na2S2O3)溶解未曝光的溴化银(AgBr),生成含Na3[Ag(S2O3)2]的废定影液。S2O32-离子结构如图所示,其中心硫原子的杂化方式为_______。基态S原子中,核外电子占据的最高能级的符号是_______,占据最高能级电子的电子云轮廓图为_______形。
(4)Co可形成[Co(NH3)6]Cl2配合物。1mol [Co(NH3)6]Cl2中含有σ键的数目为_______NA;
(5)镧镍合金是重要储氢材料。镧镍合金储氢后所得的晶体的化学式为LaNi5H6,晶胞如图所示,则Z表示的微粒为_______(填化学式),晶胞参数=_______pm。(用代数式表示,已知LaNi5H6的摩尔质量为440 g/mol,晶体密度为ρ g/cm3,NA为阿伏伽德罗常数的值)。
38.[化学——选修5:有机化学基础](15分) 阿莫西林是一种最常用的半合成青霉素类广谱β-内酰胺类抗生素,某研究小组按图中路线合成:
已知:RCHO
请回答:
(1)C的结构简式为___________。
(2)下列说法不正确的是___________。
A.化合物B含有羟基
B.反应⑤发生了加成反应
C.化合物D能发生消去反应
D.阿莫西林的分子式是C16H21N3O5S
(3)写出第⑨步反应的化学反应方程式___________________________________。
(4)设计从出发制备阿司匹林( )的合成路线(用流程图表示,其他试剂任选)___ ____________________________________________。
(5)写出同时符合下列条件的F的所有同分异构体的结构简式___________。
①分子中有苯环且是苯环的对位二取代物
②分子中含有硝基且不与苯环直接相连
③分子不与金属钠反应放出氢气
贵州省贵阳市2022年高考理综 化学模拟试题 08(含答案及解析): 这是一份贵州省贵阳市2022年高考理综 化学模拟试题 08(含答案及解析),文件包含贵州省贵阳市2022年高考理综化学模拟试题08doc、贵州省贵阳市2022年高考理综化学模拟试题08答案及解析doc等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
贵州省贵阳市2022年高考理综 化学模拟试题 07(含答案及解析): 这是一份贵州省贵阳市2022年高考理综 化学模拟试题 07(含答案及解析),文件包含贵州省贵阳市2022年高考理综化学模拟试题07doc、贵州省贵阳市2022年高考理综化学模拟试题07答案及解析doc等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
贵州省贵阳市2022年高考理综 化学模拟试题 05(含答案及解析): 这是一份贵州省贵阳市2022年高考理综 化学模拟试题 05(含答案及解析),文件包含贵州省贵阳市2022年高考理综化学模拟试题05doc、贵州省贵阳市2022年高考理综化学模拟试题05答案及解析doc等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。












