

2022 高考化学二轮专题练习 专题突破练九 水溶液中的离子平衡
展开
这是一份2022 高考化学二轮专题练习 专题突破练九 水溶液中的离子平衡,共14页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
专题突破练九 水溶液中的离子平衡
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2021河北邯郸模拟)工业上向锅炉里注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,而后用盐酸去除。下列叙述不正确的是( )
A.温度升高,Na2CO3溶液的KW和c(OH-)均会增大
B.沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)CaCO3(s)+SO42-(aq)
C.盐酸中CaCO3的溶解性大于CaSO4
D.Na2CO3溶液遇CO2后,阴离子浓度均减小
2.(2021湖南浏阳模拟)25 ℃时,改变0.1 mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=c(RCOOH)c(RCOOH)+c(RCOO-)],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是( )
A.若弱酸pH增大是通过向弱酸中加入NaOH固体实现的,则图中M、N两点对应溶液中的c(Na+)相等
B.对于甲酸和丙酸,当lgc(RCOOH)c(RCOO-)>0时,溶液都为酸性
C.等浓度的HCOONa和CH3CH2COONa两种溶液中的c(OH-)相等
D.将0.1 mol·L-1的HCOOH溶液与0.1 mol·L-1的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
3.(2021河北秦皇岛模拟)常温下,向NaOH溶液中逐滴滴入亚磷酸(H3PO3),反应中只能生成Na2HPO3和NaH2PO3两种盐,含磷各微粒的分布分数X(平衡时某微粒的浓度占各微粒浓度之和的分数)与pOH[pOH=-lgc(OH-)]的关系如图所示。下列说法不正确的是( )
A.曲线a代表X(HPO32-)
B.pOH=7时,c(Na+)=c(H2PO3-)+2c(HPO32-)
C.H2PO3-的电离平衡常数Ka=1×10-6.7
D.等浓度Na2HPO3和NaH2PO3混合溶液:c(Na+)>c(HPO32-)>c(H2PO3-)>c(OH-)>c(H+)
4.(2020山东聊城模拟)常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是( )
A.V=40
B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.NH3·H2O的电离常数K=10-4
D.d点所示溶液中:c(NH4+)=2c(SO42-)
5.(2020广东湛江模拟)依据下表有关铁的难溶化合物的溶度积,有关说法正确的是( )
化合物
溶度积(25 ℃)
化合物
溶度积(25 ℃)
FeCO3
3.2×10-11
Fe(OH)3
4.0×10-38
Fe(OH)2
8.0×10-11
FeS
6.3×10-18
A.在c(CO32-)=0.1 mol·L-1溶液中,c(Fe2+)≥3.2×10-10 mol·L-1
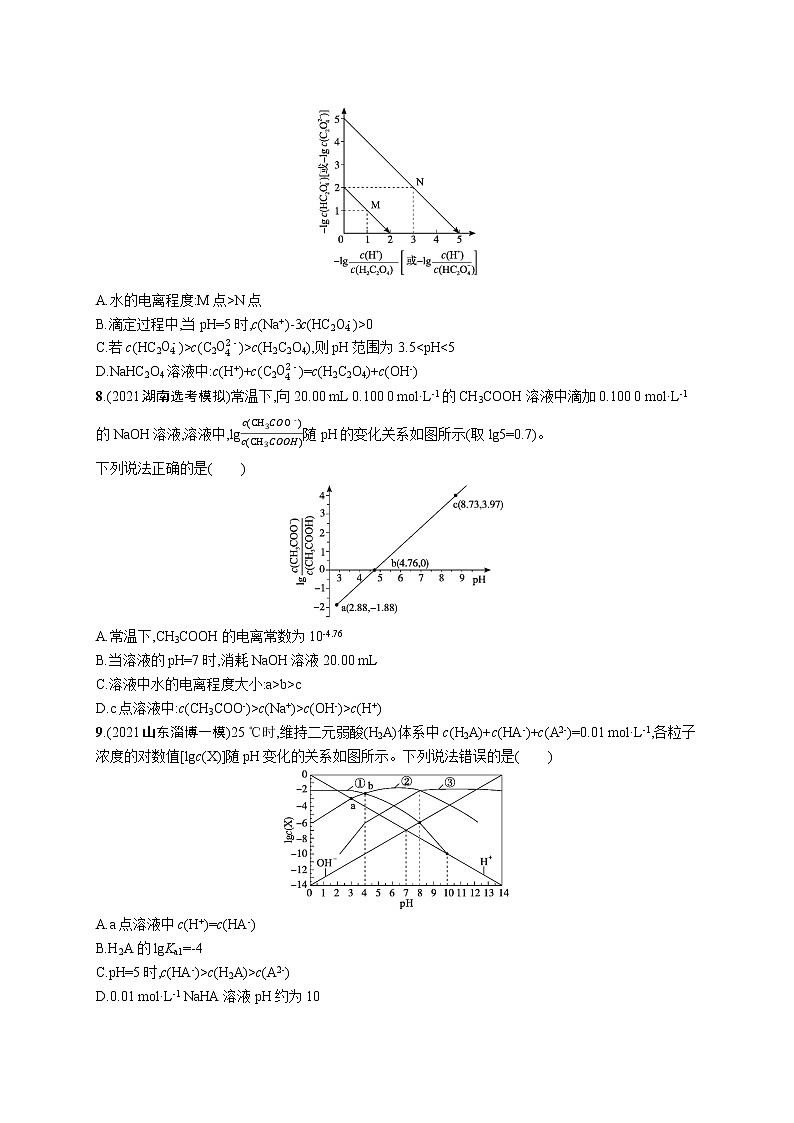
B.将FeCl2和FeCl3溶液分别调至pH=10,则c(Fe2+)N点
B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O4-)>0
C.若c(HC2O4-)>c(C2O42-)>c(H2C2O4),则pH范围为3.5c
D.c点溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
9.(2021山东淄博一模)25 ℃时,维持二元弱酸(H2A)体系中c(H2A)+c(HA-)+c(A2-)=0.01 mol·L-1,各粒子浓度的对数值[lgc(X)]随pH变化的关系如图所示。下列说法错误的是( )
A.a点溶液中c(H+)=c(HA-)
B.H2A的lgKa1=-4
C.pH=5时,c(HA-)>c(H2A)>c(A2-)
D.0.01 mol·L-1 NaHA溶液pH约为10
10.(2021山东泰安一模)已知:乙二胺(H2NCH2CH2NH2),无色液体,25 ℃时,K1=10-4.07,K2=10-7.15,有类似氨的性质。向10 mL浓度为0.1 mol·L-1的乙二胺溶液中滴加0.1 mol·L-1的盐酸,溶液中lgc(H+)c(OH-)与所加盐酸的体积关系如图所示。下列说法正确的是( )
A.H2NCH2CH2NH2在水溶液中电离方程式为:H2NCH2CH2NH2+2H2O[H3NCH2CH2NH3]2++2OH-
B.溶液中水的电离程度:a点大于b点
C.a点:盐酸的体积大于10 mL
D.b点所处的溶液中:c(H+)=c(OH-)+2c(H2NCH2CH2NH2)+2c([H2NCH2CH2NH3]+)
11.(2021广东选考模拟)叠氮酸(HN3)与NaOH溶液反应生成NaN3。已知NaN3溶液呈碱性,下列叙述正确的是( )
A.0.01 mol·L-1 HN3溶液的pH=2
B.HN3溶液的pH随温度升高而减小
C.NaN3的电离方程式:NaN3Na++3N3-
D.0.01 mol·L-1 NaN3溶液中:c(H+)+c(Na+)=c(N3-)+c(HN3)
12.(2021广东选考模拟)水体中重金属铅的污染问题备受关注。溶液中Pb2+及其与OH-形成的微粒的浓度分数α随溶液pH变化的关系如图所示。已知NH3·H2O的Kb=1.74×10-5。向Pb(NO3)2溶液中滴加氨水,关于该过程的说法正确的是( )
A.Pb2+的浓度分数先减小后增大
B.c(NO3-)与c(Pb2+)的比值先减小后增大,pH>10后不变
C.pH=7时,存在的阳离子仅有Pb2+、Pb(OH)+和H+
D.溶液中Pb2+与Pb(OH)2浓度相等时,氨主要以NH4+的形式存在
13.(2021湖北选考模拟)室温下,通过下列实验探究Na2CO3溶液的性质。
实验
实验操作和现象
1
用pH试纸测定0.1 mol·L-1 Na2CO3溶液的pH,测得pH约为12
2
向0.1 mol·L-1 Na2CO3溶液中加入过量0.2 mol·L-1 CaCl2溶液,产生白色沉淀
3
向0.1 mol·L-1 Na2CO3溶液中通入过量CO2,测得溶液pH约为8
4
向0.1 mol·L-1 Na2CO3溶液中滴加几滴0.05 mol·L-1 HCl,观察不到实验现象
下列有关说法正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中存在c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-)
B.实验2反应静置后的上层清液中有c(Ca2+)·c(CO32-)δ(RCOO-),根据图知,甲酸中M点前、丙酸中N点前溶液都呈酸性,故B正确;C项,等浓度的HCOONa和CH3CH2COONa两种溶液中,水解程度:甲酸钠c(OH-),故D错误。
3.D 解析:向NaOH溶液中逐滴滴入亚磷酸,NaOH过量,反应先生成Na2HPO3,所以曲线a代表X(HPO32-);继续滴加亚磷酸,Na2HPO3浓度降低,NaH2PO3升高,所以曲线b代表X(H2PO3-),曲线c代表X(H3PO3)。由以上分析可知A项说法正确;pOH=7时,c(OH-)=c(H+),溶液中存在Na2HPO3和NaH2PO3两种溶质,根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(H2PO3-)+2c(HPO32-),其中c(OH-)=c(H+),即c(Na+)=c(H2PO3-)+2c(HPO32-),故B正确;H2PO3-在溶液中存在电离平衡H2PO3-H++HPO32-,平衡常数Ka=c(HPO32-)·c(H+)c(H2PO3-),pOH=7.3时,c(HPO32-)=c(H2PO3-)且c(H+)=10-(14-pOH) mol·L-1=10-6.7 mol·L-1,所以Ka=10-6.7,故C正确;D项,等浓度Na2HPO3和NaH2PO3混合溶液中,H2PO3-既电离又水解,其水解常数Kh=KWKa1(H3PO3),Ka1(H3PO3)=c(H+)·c(H2PO3-)c(H3PO3)=10-1.4,则Kh=10-1410-1.4c(HPO32-)>c(H2PO3-)>c(H+)>c(OH-),故D错误。
4.D 解析:c点水的电离程度最大,说明此时c(NH4+)最大,对水的电离促进程度最大,氨水与硫酸恰好完全反应生成(NH4)2SO4,氨水体积为0时,水电离出的c(H+)=1×10-13 mol·L-1,水电离出的c(OH-)=1.0×10-13 mol·L-1,溶液中的c(H+)=0.1 mol·L-1,c(H2SO4)=0.05 mol·L-1,消耗氨水的体积也是20 mL,即V=20,A错误;c点所示溶液是(NH4)2SO4溶液,由质子守恒得c(H+)-c(OH-)=c(NH3·H2O),B错误;根据题意,无法判断NH3·H2O的电离常数的大小,C错误;根据电荷守恒:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),而溶液呈中性c(OH-)=c(H+),所以c(NH4+)=2c(SO42-),D正确。
5.D 解析:A项,c(Fe2+)≤3.2×10-10 mol·L-1(若大于3.2×10-10 mol·L-1,则生成沉淀),错误;B项,pH=10,此时c(OH-)=1×10-4 mol·L-1,c(Fe2+)=8.0×10-3 mol·L-1,c(Fe3+)=4.0×10-26 mol·L-1,错误;C项,酸性增强,FeS、FeCO3会溶解:FeS+2H+Fe2++H2S↑、FeCO3+2H+Fe2++H2O+CO2↑,错误;D项,由于Ksp[Fe(OH)3]远小于Ksp[Fe(OH)2],正确。
6.C 解析:浓度均为0.1 mol·L-1的NaOH溶液和H3PO4溶液按照体积比2∶1混合,二者恰好反应生成Na2HPO4,在溶液中HPO42-存在电离平衡:HPO42-PO43-+H+,也存在着水解平衡:HPO42-+H2OH2PO4-+OH-,电离平衡常数Ka3=4.4×10-13,水解平衡常数Kh2=c(H2PO4-)·c(OH-)c(HPO42-)=c(H2PO4-)·c(OH-)·c(H+)c(HPO42-)·c(H+)=KWKa2=10-146.3×10-8≈1.58×10-7>Ka3=4.4×10-13,水解程度大于电离程度,因此溶液显碱性,pH>7,A错误;在Na2HPO4溶液中,根据质子守恒可得:c(H+)+c(H2PO4-)+2c(H3PO4)=c(PO43-)+c(OH-),B错误;向0.1 mol·L-1的H3PO4溶液中通入HCl气体(忽略溶液体积的变化),溶液pH=1时,c(H+)=0.1 mol·L-1,根据电离平衡常数Ka1=c(H+)·c(H2PO4-)c(H3PO4)=0.1×c(H2PO4-)c(H3PO4)=7.6×10-3,c(H2PO4-)c(H3PO4)=7.6×10-2,溶液中c(H3PO4)≈0.1 mol·L-1-c(H2PO4-),则c(H2PO4-)≈7.1×10-3 mol·L-1,因此溶液中电离的H3PO4大约有7.1%,C正确;在H3PO4溶液中加入NaOH溶液,随着NaOH的加入,溶液的pH增大,当溶液的pH=11时,c(H+)=10-11 mol·L-1,Ka3=c(H+)·c(PO43-)c(HPO42-)=10-11×c(PO43-)c(HPO42-)=4.4×10-13,则c(PO43-)c(HPO42-)=4.4×10-2,则c(PO43-)Ka2=c(H+)·c(C2O42-)c(HC2O4-),由电离常数可知-lgc(H+)c(H2C2O4)=-lgKa1c(HC2O4-),-lgc(H+)c(HC2O4-)=-lgKa2c(C2O42-),由图可知,当c(H+)=c(H2C2O4)或c(H+)=c(HC2O4-)时可得Ka1=10-2、Ka2=10-5,则下端直线代表-lgc(H+)c(H2C2O4)和-lgc(HC2O4-)的关系,上端直线代表-lgc(H+)c(HC2O4-)和-lgc(C2O42-)的关系。A项,由分析可知,M点对应草酸的第一步电离,N点对应第二步电离,水的电离程度N点>M点,故A错误;B项,当pH=5时,由Ka2=c(H+)·c(C2O42-)c(HC2O4-)=10-5可得c(HC2O4-)=c(C2O42-),溶液中的电荷守恒关系为c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),整合两式可得c(Na+)-3c(HC2O4-)=c(OH-)-c(H+)c(C2O42-)>c(H2C2O4)可得c(HC2O4-)c(H2C2O4)>c(C2O42-)c(H2C2O4)>1,由电离常数可得Ka1c(H+)>Ka1×Ka2c2(H+)>1,解不等式可知氢离子的范围为10-5 mol·L-1c(OH-)>c(H+),故D不正确。
9.D 解析:根据图像分析可知,随着pH的升高,开始阶段H2A浓度减小,HA-离子浓度增大,再随pH的升高,H2A浓度继续减小,HA-离子浓度减小,A2-离子浓度逐渐增大至基本不变,故可推知,图中曲线①为lgc(H2A)随pH的变化曲线,曲线②为lgc(HA-)随pH的变化曲线,曲线③为lgc(A2-)随pH的变化曲线。a点时,lgc(HA-)=lgc(H+),则c(HA-)=c(H+),A正确;b点时c(HA-)=c(H2A),则H2A的Ka1=c(H+),lgKa1=lgc(H+)=-4,B正确;由图像知pH=5时,c(HA-)>c(H2A)>c(A2-),C正确;由图像知pH=8时,c(HA-)=c(A2-),则H2A的Ka2=c(H+),lgKa2=lgc(H+)=-8,Ka2=10-8,0.01 mol·L-1 NaHA溶液中,c(HA-)>c(A2-),则pH小于8,D错误。
10.C 解析:A.H2NCH2CH2NH2作为二元弱碱,电离方程式应分步书写,一般只写第一步:H2NCH2CH2NH2+H2O[H3NCH2CH2NH2]++OH-;B.a点溶液呈中性,水的电离程度与纯水相同,b点溶液的溶质是正盐,水解程度最大,水的电离程度最大,故溶液中水的电离程度a点小于b点;C.若盐酸的体积等于10 mL,则溶质为[H2NCH2CH2NH3]Cl,由于K2=10-7.15>Kh=10-9.93,该溶液显碱性,而a点溶液显中性,所以要继续加盐酸,故a点盐酸的体积大于10 mL;D.b点所处的溶液中的溶质为[H3NCH2CH2NH3]Cl2,其质子守恒关系式为c(H+)=c(OH-)+2c(H2NCH2CH2NH2)+c([H2NCH2CH2NH3]+)。
11.B 解析:由题意,NaN3溶液呈碱性,则叠氮酸根(N3-)会发生水解,说明HN3为弱酸,在水溶液中不能完全电离,故0.01 mol·L-1 HN3溶液的pH>2,A错误;HN3为弱酸,电离方程式为HN3H++N3-,电离是吸热过程,升高温度促进HN3的电离,c(H+)增大,pH减小,B正确;NaN3是强电解质,完全电离出Na+和N3-,电离方程式为NaN3Na++N3-,C错误;0.01 mol·L-1 NaN3溶液中,由物料守恒:c(Na+)=c(N3-)+c(HN3),故D错误。
12.D 解析:随着pH的增大,Pb2+的浓度分数逐渐减小,当pH=10时,Pb2+的浓度分数减小为0,A错误;NO3-与Pb2+在同一溶液中,c(NO3-)与c(Pb2+)的比值等于其物质的量之比,滴加氨水过程中,随着pH的增大,n(Pb2+)逐渐减小,n(NO3-)不变,n(NO3-)与n(Pb2+)的比值增大,故c(NO3-)与c(Pb2+)的比值增大,pH>10,c(Pb2+)减小为0时,比值无意义,B错误;当pH=7时,结合图示可知,溶液中存在的阳离子有Pb2+、Pb(OH)+、H+以及NH4+,C错误;当溶液中Pb2+与Pb(OH)2浓度相等时,由图可知,此时溶液pH约等于8,由NH3·H2O电离常数Kb=c(NH4+)·c(OH-)c(NH3·H2O)=1.74×10-5,则c(NH4+)c(NH3·H2O)=Kbc(OH-)=1.74×10-51.0×10-6=17.4,故溶液中氨主要以NH4+形式存在,D正确。
13.A 解析:0.1 mol·L-1 Na2CO3溶液存在质子守恒:c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-),故A正确;实验2反应静置后的上层清液是饱和溶液,此时达到沉淀溶解平衡,c(Ca2+)·c(CO32-)=Ksp(CaCO3),故B错误;向0.1 mol·L-1 Na2CO3溶液中通入过量CO2,发生反应Na2CO3+CO2+H2O2NaHCO3,HCO3-水解程度大于电离程度,溶液显碱性,但水解和电离的部分还是较少,所以c(HCO3-)>c(CO32-),故C错误;向0.1 mol·L-1 Na2CO3溶液中滴加几滴0.05 mol·L-1 HCl,反应的化学方程式为Na2CO3+HClNaHCO3+NaCl,故D错误。
14.B 解析:当酸性越强时,曲线Ⅰ表示的微粒的含量越高,可推知曲线Ⅰ是H2C2O4的变化曲线,曲线Ⅱ是HC2O4-的变化曲线,曲线Ⅲ是C2O42-的变化曲线,A错误;在a点H2C2O4的浓度和HC2O4-的浓度相等,pH=1.22,则草酸H2C2O4第一步电离的电离常数K=c(HC2O4-)·c(H+)c(H2C2O4)=c(H+)=10-1.22,则B正确;在b点,c(C2O42-)=c(HC2O4-),且溶液呈酸性,若c(C2O42-)+2c(OH-)=c(HC2O4-)+c(H+),则2c(OH-)=c(H+),显然不成立,C错误;在c点,HC2O4-的含量为0.15,而起始时H2C2O4的物质的量为0.1 L×0.40 mol·L-1=0.04 mol,则HC2O4-的物质的量为0.15×0.04 mol=0.006 mol,溶液体积为0.2 L,c(HC2O4-)=0.006mol0.2 L=0.03 mol·L-1,D错误。
15.B 解析:向20 mL 0.1 mol·L-1的氨水中滴加未知浓度的稀硫酸,反应放热,溶液的温度升高,当二者恰好完全反应时,放热最多,溶液的温度最高,所以稀硫酸的体积为20 mL时,恰好完全反应。A项,由以上分析可知:加入20 mL稀硫酸与氨水恰好完全反应,硫酸是二元酸,一水合氨是一元碱,所以稀硫酸的物质的量浓度为0.05 mol·L-1,故不选A;B项,当溶液中pH=pOH时,溶液呈中性,水的电离既不被促进也不被抑制,而不滴加硫酸时,溶液显碱性,抑制水的电离,当硫酸过量时,也抑制水的电离,氨水与硫酸恰好反应生成硫酸铵时水的电离程度最大,故选B;C项,a点时反应后溶质为一水合氨和硫酸铵,且硫酸铵为一水合氨浓度的一半,由电荷守恒c(NH4+)+c(H+)=c(OH-)+2c(SO42-)和物料守恒4c(SO42-)=c(NH4+)+c(NH3·H2O)得c(NH3·H2O)+2c(OH-)=c(NH4+)+2c(H+),故不选C;D项,升高温度促进铵根离子水解,水解常数增大,由图可知,温度:b>a>c,则a、b、c三点对应NH4+的水解平衡常数:Kh(b)>Kh(a)>Kh(c),故不选D。
16.C 解析:“还原焙烧”时过量炭黑将废料[含MnO2、MnOOH、Zn(OH)2及少量Fe]中的MnO2、MnOOH还原为MnO,Zn(OH)2受热分解产生ZnO,“还原焙烧后”得到含MnO、ZnO、Fe、炭黑的固体;“酸浸”时硫酸和MnO、ZnO、Fe反应,过滤除去炭黑,滤渣1主要成分为炭黑,得到含Mn2+、Zn2+、Fe2+、Fe3+、H+的滤液;“净化”时加合适的氧化剂将Fe2+氧化为Fe3+,再调pH到适当范围使Fe3+形成沉淀,然后过滤除去,滤渣2主要成分为Fe(OH)3;通过“电解”阳极得到MnO2,阴极得到Zn。A项,从流程和信息来看加入过量炭黑主要作用是将MnO2、MnOOH转化为MnO,A正确;B项,若“酸浸”时,用浓盐酸代替稀硫酸,则溶液中含氯离子,电解时阳极产生氯气,不产生MnO2,因此“酸浸”时,不可以用浓盐酸代替稀硫酸,B正确;C项,Ksp[Fe(OH)3]=10-38,Fe3+完全沉淀时其浓度≤10-5 mol·L-1,当Fe3+浓度为10-5 mol·L-1时,c3(OH-)=10-3810-5=10-33,c(OH-)=10-11 mol·L-1,则要使Fe3+沉淀完全,需满足c(OH-)≥10-11 mol·L-1,pH≥3;Ksp[Mn(OH)2]=10-13,Mn2+开始沉淀时,10-13=0.1×c2(OH-),c2(OH-)=10-12,c(OH-)=10-6,pH=8;Ksp[Zn(OH)2]=10-17,Zn2+开始沉淀时,10-17=0.1×c2(OH-),c2(OH-)=10-16,c(OH-)=10-8,pH=6;本题中,净化的目的是使Fe3+沉淀而除去,但不能使Zn2+、Mn2+形成沉淀,因此调节pH的合理范围是3≤pH
相关试卷
这是一份2023二轮复习专项练习(化学)专题突破练十 水溶液中的离子平衡(B),共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2023二轮复习专项练习(化学)专题突破练十 水溶液中的离子平衡(A),共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2022届高考化学二轮复习专题突破练九水溶液中的离子平衡含解,共14页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








