
所属成套资源:人教版九年级上册化学课件
- 3-1 分子和原子课件PPT 课件 5 次下载
- 3-2.1 原子的结构课件PPT 课件 5 次下载
- 3-3 元素课件PPT 课件 5 次下载
- 4-1 爱护水资源课件PPT 课件 4 次下载
- 4-2 水的净化课件PPT 课件 4 次下载
初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构说课ppt课件
展开
这是一份初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构说课ppt课件,共39页。PPT课件主要包含了课前回顾,离子的形成,课堂小结,典型例题等内容,欢迎下载使用。
1.质子带正电,电子带负电,中子不带电。2.质子和中子质量近似相等,电子质量较质子和中子小得多。3.原子的质量主要集中在原子核上。4.原子中有:质子数=电子数,故原子不显电性。而中子数不一定等于质子数。5.不同原子,核内质子数、核外电子数不同。6.氢原子核内不含中子。
电子不像行星绕太阳旋转有固定的轨道,但有经常出现的区域,科学家把这样的区域称为电子层。
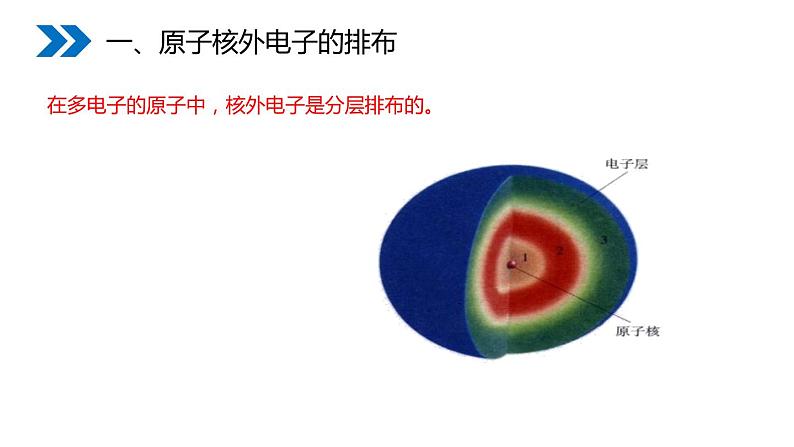
一、原子核外电子的排布
在多电子的原子中,核外电子是分层排布的。
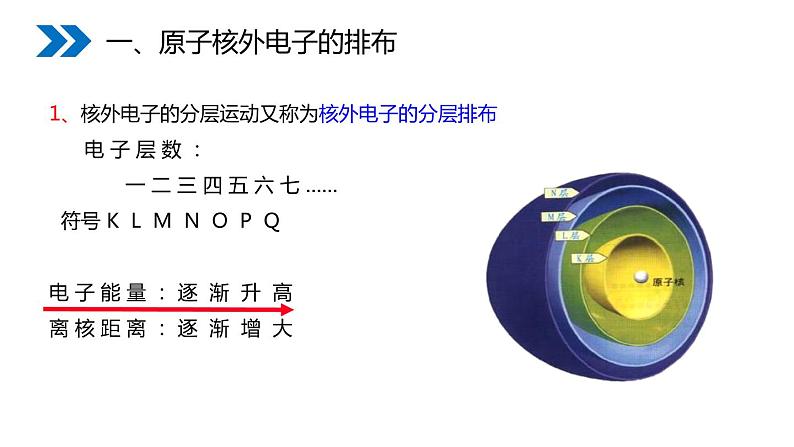
1、核外电子的分层运动又称为核外电子的分层排布 电 子 层 数 : 一 二 三 四 五 六 七 …… 符号 K L M N O P Q 电 子 能 量 : 逐 渐 升 高离 核 距 离 : 逐 渐 增 大
2、核 外 电 子 的 排 布 规 律 :
⑴ 先 排 内 层, 后排 外 层。 ⑵ 第 一 层 上 最 多 排2 个 电 子。 ⑶ 第 二 层 上 最 多 排8 个 电 子。 ⑷ 最 外 层 上 最 多 排8 个 电 子 。
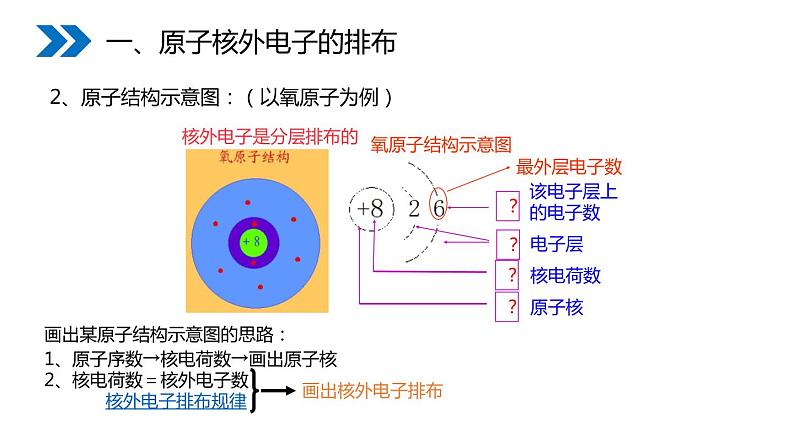
原子的结构 可用原子结构示意图简明地表示。
2、原子结构示意图:(以氧原子为例)
画出某原子结构示意图的思路:
1、原子序数→核电荷数→画出原子核
2、核电荷数=核外电子数
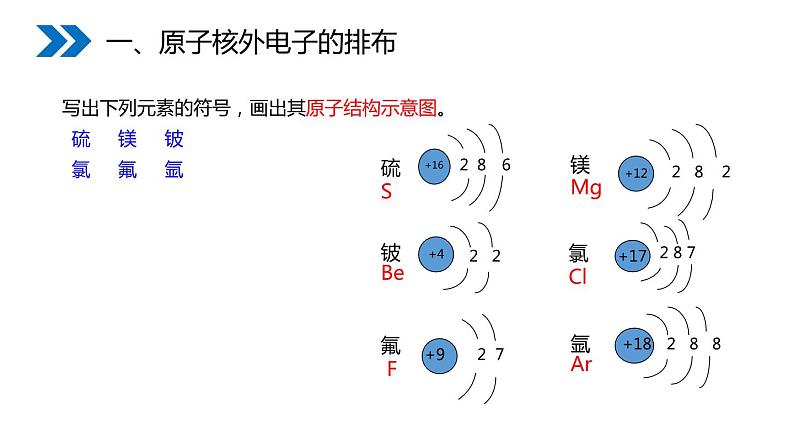
写出下列元素的符号,画出其原子结构示意图。 硫 镁 铍 氯 氟 氩
用原子结构示意图表示:1、比镁原子少1个质子的原子;2、原子核只有1个质子的原子;3、核电荷数为18的原子;
元素与最外层电子数的关系
规律;1、在同一周期中,原子的电子层数相同,最外层电子数不同,最外层电子数从左向右依次增加。2、在同一族中,最外层电子数相同,电子层数不同,从上向下电子层数依次增加。
根据所画出的原子结构示意图,你发现原子结构与元素原子的分类和化学性质有什么样的关系?
3、元素分类、原子结构与元素化学性质的关系
元素的种类由原子的 决定。
元素的化学性质主要决定于原子的 。
质子数 决定元素的种类最外层电子数决定元素的化学性质 (1)稀有气体元素:最外层电子数为8个(He 为2个),化学性质稳定,这种结构称为稳定结构; (2)金属元素:最外层电子数少于4个,易失去电子,化学性质活泼; (3)非金属元素:最外层电子数大于或等于4个,易得到电子,化学性质活泼。 结论:结构决定性质。
在化学反应中,金属元素的原子易失去最外层电子,非金属元素的原子易得到电子,目的是达到最外层8电子的稳定结构。
(1)定义:带电的原子(或原子团)叫做离子.
离子符号的表示方法是:在元素符号或原子团的右上角用数值和符号+、-表示电荷数和电性,“1”省略。 Na﹢ 、Mg2+、 Fe2+、 Fe3+,Cl﹣、OH-、CO32-、SO42-
(2)离子的分类:阳离子:带正电的离子叫阳离子。 如 Na﹢ 、Mg2+、 Fe2+ 阴离子:带负电的离子叫阴离子。如 Cl﹣、OH-、CO32-、SO42-阴、阳离子由于静电作用而形成不带电的化合物。如:Na+与Cl-由于静电作用而结合成化合物氯化钠NaCl(请看以下图示)
氯化纳(NaCl)的形成过程
阴、阳离子由于静电作用而形成不带电的化合物叫离子化合物如:Na﹢与Cl﹣由于静电作用而结合成化合物氯化钠NaCl一般来说,含金属元素的化合物是离子化合物(都是由离子构成的)NaCl MgCl2 KMnO4 Na2CO3 NaOH
结论:离子也是构成物质的粒子。
NaCl 由Na+和Cl-构成 CuSO4 由Cu2+和SO42-构成MgCl2 由Mg2+和Cl-构成 KMnO4 由K+和MnO4-构成 Na2CO3 由Na+和CO32-构成 NaOH 由Na+和OH-构成
在元素符号的右上角标出所带的电荷数,数值前符号在后,1可以省略不写。 如:Na+ Mg2+ Cl- O2-
离子的结构特点: 最外层均为稳定结构,且质子数与电子数不相等。
Cl 和Cl﹣ 、 Na 和Na﹢
思考:阳离子中,质子数大还是电子数大?阴离子呢?它们所带的电荷数与得失电子数有什么关系?
阳离子:质子数>电子数。它是原子失去电子的结果。 Na﹢ 阴离子:质子数<电子数。它是原子得到电子的结果。 Cl﹣ 数值相等
离子符号的意义(数字2的意义)
表示1个镁离子带两个单位的正电荷
氢氧根离子 OH-硝酸根离子 NO3-碳酸根离子 CO32-硫酸根离子 SO42-铵根离子 NH4+亚铁离子 Fe2+铁离子 Fe3+
排布特点1:电子在核外是分层排布的。
排布特点2: 原子的第一层最多排2个电子,第二层最多排8个电子,最外层电子数最多不超过8个(只有1层的不超过2个电子)。
例1、钠原子和钠离子的结构示意图如下(填“相同”和“不同”)⑴最外层电子数________⑵核外电子层数__________⑶核内质子数__________⑷核外电子总数________⑸粒子的电性__________⑹粒子的化学性质______⑺核内中子数__________
1. 在化学反应里,元素的原子结构发生变化的是 ( )A 、质子数 B 、最外层电子数 C 、中子数 D、核电荷数
3、对结构示意图为 两种微粒,有下列说法 ①属于同一元素 ②都具有稳定结构 ③核外电子排布相同 ④都不带电荷 其中说法正确的是( ) A ①② B ②③ C ①②④ D ②③④
4、写出下列微粒的质子数和电子数
相关课件
这是一份化学九年级上册课题2 原子的结构教案配套ppt课件,共60页。
这是一份人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构多媒体教学课件ppt,共46页。PPT课件主要包含了核外电子的排布,原子结构示意图,离子的形成,基础练习,能力提高等内容,欢迎下载使用。
这是一份初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构教课ppt课件,共21页。PPT课件主要包含了课前导入,课堂探究,原子的质量测定值,碳原子质量,碳原子质量的112,Ar=,定义式,近似值,测定出来绝对的,比较得出相对的等内容,欢迎下载使用。