






高中第一节 反应热示范课课件ppt
展开一、中和反应反应热的测定
测定原理:Q=cm△t
c反应溶液的比热容,单位质量的某物质温度升高1℃所吸收的热量。
中和热:强酸与强碱的稀溶液发生中和反应,生成1ml液态水,释放的能量。
a、在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如上图所示。该实验也可在保温杯中进行。
b、用一个量筒量取50mL 0.5ml/L盐酸, 倒入 小烧杯中,并用温度计测量盐酸的温度,记录。 把温度计上的酸用水冲洗干净。
c、用另一个量筒量取50mL 0.55ml/L氢氧化钠,并用温度计测量氢氧化钠的温度,记录。
d、把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒在外面),盖好盖板。用环形玻璃搅拌棒轻轻搅动溶液,并准确量取混合溶液的最高温度,记为终止温度,记录。
e、重复实验步骤2—4三次
如何提高中和热测定的准确度呢?
增强保温、隔热措施,减少实验过程中热量的损失。不断搅动,使热量分散均匀。使用稀酸溶液和稀碱溶液,减少溶解热的干扰。使用强酸和强碱溶液,减少电离热效应的干扰。
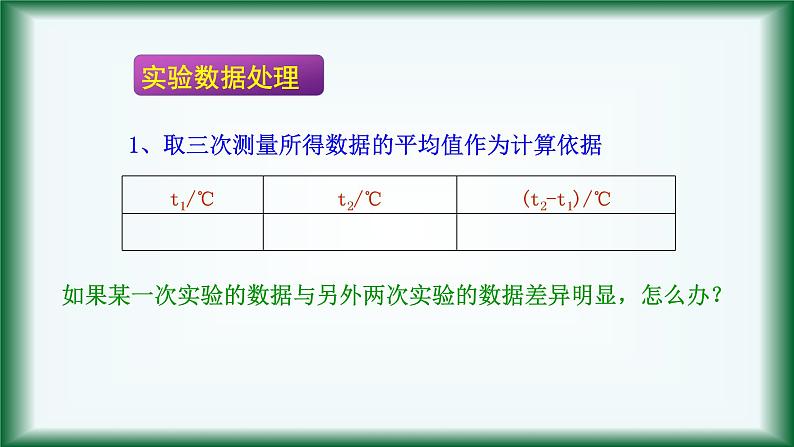
1、取三次测量所得数据的平均值作为计算依据
如果某一次实验的数据与另外两次实验的数据差异明显,怎么办?
2.计算反应热50mL0.50 ml/L的盐酸的质量m1=50g50mL0.55 ml/L的氢氧化钠溶液的质量m2=50g中和后生成的溶液的比热容c=4.18J/(g·℃)
Q=(m1+ m2 )c (t2-t1) =0.418(t2-t1)kJ
生成1mlH2O时放出的热量为:
参考值:-57.3kJ/ml
若改用100mL0.50ml/L的盐酸和100mL0.55ml/L的NaOH溶液,所测得中和热的数值是否约为本实验结果的两倍(假定各步骤操作没有失误)?
答:否。因为中和热是指酸与碱发生中和反应生成1mlH2O时放出的热量,其数值与反应物的量无关,故所测结果应基本和本次实验结果相同。
例1.下列关于中和反应反应热的说法中正确的是( )A.10 L 0.1 ml·L-1 NaOH溶液与10 L 0.1 ml·L-1盐酸反应时的反应热ΔH=-57.3 kJ·ml-1B.1 ml HCl气体通入1 L 0.01 ml·L-1 NaOH溶液中反应时的反应热ΔH=-57.3 kJ·ml-1C.1 ml CH3COOH与2 ml NaOH溶液反应时的反应热ΔH=-57.3 kJ·ml-1D.只要强酸与强碱在稀溶液中反应生成1 ml水时的反应热ΔH=-57.3 kJ·ml-1
【例2】强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1。稀醋酸、浓硫酸、稀硝酸分别与1.0 L 0.1 ml·L-1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示。已知CH3COOH电离时吸热,则下列描述正确的是( )A.线A表示稀硝酸与NaOH溶液反应B.线B表示稀醋酸与NaOH溶液反应C.b=5.73D.线C表示浓硫酸与NaOH溶液反应
【练习】将V1 mL 1.00 ml/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )A.做该实验时环境温度是22 ℃B.该实验表明化学能可以转化为热能C.NaOH溶液的浓度约为1.50 ml/LD.该实验表明有水生成的反应都是放热反应
如何测出这个反应的反应热:C(s)+1/2O2(g)==CO(g) ;ΔH1=?
有些反应的反应速率很慢,有些反应同时有副反应发生,还有些反应在通常条件下不易直接进行,因而测定这些反应的热效应就很困难
如何测定C(s)+1/2O2(g)==CO(g)的反应热△H
(1) C(s) + O2(g) = CO2(g) △H1 = -393.5kJ/ml
(2) CO(g) + ½ O2(g) = CO2(g) △H2 = -283.0kJ/ml
(3) C(s) + ½ O2(g) = CO (g) △H = -110.5kJ/ml
不管化学反应是一步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
——盖斯(瑞士化学家)
化学热力学之父能量守恒的先驱
1802年8月8日生于瑞士日内瓦市一位画家家庭,1825年毕业于多尔帕特大学医学系,并取得医学博士学位。1826年弃医专攻化学,1828年由于在化学上的卓越贡献被选为圣彼得堡科学院院士,1838年被选为俄国科学院院士。1850年12月13日盖斯卒于圣彼得堡。 1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的热量。1836年经过许多次实验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1860年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。 盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。当一个不能直接发生的反应要求反应热时,便可以用分步法测定反应热并加和起来而间接求得。故而我们常称盖斯是热化学的奠基人。
化学反应的焓变仅与反应的起始状态和反应的最终状态有关,而与反应途径无关
如何测出这个反应的反应热:① C(s)+1/2O2(g)==CO(g) ;ΔH1=?
②CO(g)+1/2O2(g)= CO2(g) ΔH2=-283.0kJ/ml③C(s)+O2(g)=CO2(g) ΔH3=-393.5kJ/ml
-110.5kJ/ml
C(s) + O2(g)
CO(g) + ½ O2(g)
△H3 = △H1 - △H2
不管C(s)是一步反应生成CO2(g),还是分步最终生成CO2(g),其反应热是相同的。
△H1 = △H2 + △H3
例1、同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。
已知:①C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ/ml②C(金刚石,s)+O2(g)=CO2(g) △H2=-395.0kJ/ml
C(石墨,s)= C(金刚石,s) △H=+1.5kJ/ml
试写出石墨转化为金刚石的热化学方程式:
C(石墨,s)= C(金刚石,s) △H=?
解答该类题目的一般步骤(1)根据待求解的热化学方程式中的反应物和生成物找出可用的已知热化学方程式。(2)①根据待求解的热化学方程式调整可用热化学方程式的方向,同时调整ΔH的符号。②根据待求解的热化学方程式将调整好的热化学方程式进行化简或扩大相应的倍数。(3)将调整好的热化学方程式和ΔH进行加合。(4)ΔH随热化学方程式的调整而相应地进行加、减、乘、除运算。(5)检查得出的热化学方程式是否正确。
应用盖斯定律计算反应热的方法
热化学方程式加合法:运用所给方程式就可通过加减的方法得到新化学方程式。
应用盖斯定律计算反应热时的注意事项:1. 热化学方程式同乘以某一个数时,反应热数值也必须乘上该数2. 热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减(带符号)3. 将一个热化学方程式颠倒时,∆H 的“+”、“-”号必须随之改变,但数值不变。
【例 2】已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH12H2(g)+O2(g)===2H2O(g) ΔH2C(s)+O2(g)===CO2(g) ΔH3则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为A.12ΔH3+5ΔH2-2ΔH1B.2ΔH1-5ΔH2-12ΔH3C.12ΔH3-5ΔH2-2ΔH1D.2ΔH1-5ΔH2+12ΔH3
将已知方程式依次编号为①②③,利用盖斯定律,由②×5+③×12-①×2得目标方程式,则ΔH=5ΔH2+12ΔH3-2ΔH1,A正确。
【例3】已知25 ℃、101 kPa时:4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1648 kJ·ml-1①C(s)+O2(g)===CO2(g) ΔH=-393 kJ·ml-1②2Fe(s)+2C(s)+3O2(g)===2FeCO3(s) ΔH=-1480 kJ·ml-1③FeCO3在空气中加热反应生成Fe2O3和CO2的热化学方程式是____________________________________________________。
4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·ml-1
解析 根据盖斯定律:①+②×4-③×2可得:4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·ml-1。
【例4】盖斯定律认为能量总是守恒的,化学反应过程一步完成或分步完成,整个过程的热效应是相同的。已知:①H2O(g)===H2O(l) ΔH1=-Q1 kJ/ml②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ/ml③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/ml若使23 g液态酒精完全燃烧,最后恢复到室温,则放出的热量为(kJ)( )A.Q1+Q2+Q3 B.1.5Q1-0.5Q2+0.5Q3C.0.5Q1-1.5Q2+0.5Q3 D.0.5(Q1+Q2+Q3)
例5、黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·ml-1已知:C(s)+O2(g)===CO2(g) ΔH1=a kJ·ml-1S(s)+2K(s)===K2S(s) ΔH2=b kJ·ml-12K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·ml-1则x为( )A.3a+b-c B.c-3a-bC.a+b-c D.c-a-b
化学选择性必修1第一单元 化学反应的热效应集体备课课件ppt: 这是一份化学选择性必修1第一单元 化学反应的热效应集体备课课件ppt,共26页。PPT课件主要包含了学习目标,二盖斯定律,三反应热的计算等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应背景图ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应背景图ppt课件,共46页。PPT课件主要包含了学习目标,核心素养,活动探究,归纳总结,巩固练习,盖斯定律,完全相等,根据盖斯定律知,能力提升,举一反三等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应教学课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应教学课件ppt,共44页。PPT课件主要包含了分点突破1,反应热的测量实验,分点突破2,盖斯定律,关键能力培养,归纳与论证能力等内容,欢迎下载使用。














