






鲁科版 (2019)必修 第一册第3章 物质的性质与转化第1节 铁的多样性示范课ppt课件
展开1.绘制铁及其化合物的“价—类”二维图,并表示各物质之间的转化关系,示例如下:
2.补铁剂中铁元素价态的检验(1)Fe3+的检验方法很多,但在没有特殊要求的条件下,最好选择KSCN溶液,此法灵敏且现象明显。(2)检验Fe2+的最好方法是加KSCN溶液(无明显现象),然后加氯水(溶液变红色)。【微思考1】如何检验某铁的氧化物中含有Fe2+?提示:取少量固体置于试管中,向其中加入稀盐酸配制成溶液,加入酸性高锰酸钾溶液,高锰酸钾溶液褪色,证明氧化物中含有Fe2+。【微思考2】碱性氧化物是否都能与水反应生成相应的碱?FeO与硝酸(具有强氧化性)反应是氧化还原反应吗?提示:碱性氧化物不一定都能溶于水与水反应,如FeO、Fe2O3都难溶于水,与水不反应,因此不能与水反应生成相应的碱。FeO具有还原性,与硝酸反应生成硝酸铁和氮的氧化物,属于氧化还原反应。
1.下列物质中,不能由两种单质直接化合得到的是 ( )A.FeCl2B.CuCl2C.HClD.Na2O2答案:A解析:Fe和Cl2反应生成FeCl3,所以FeCl2不能由两种单质直接化合得到,A项符合题意;Cu与Cl2反应生成CuCl2,CuCl2能由两种单质直接化合得到,B项不符合题意;H2、Cl2点燃生成HCl,HCl能由两种单质直接化合得到,C项不符合题意;Na与O2在加热时生成Na2O2,Na2O2能由两种单质直接化合得到,D项不符合题意。
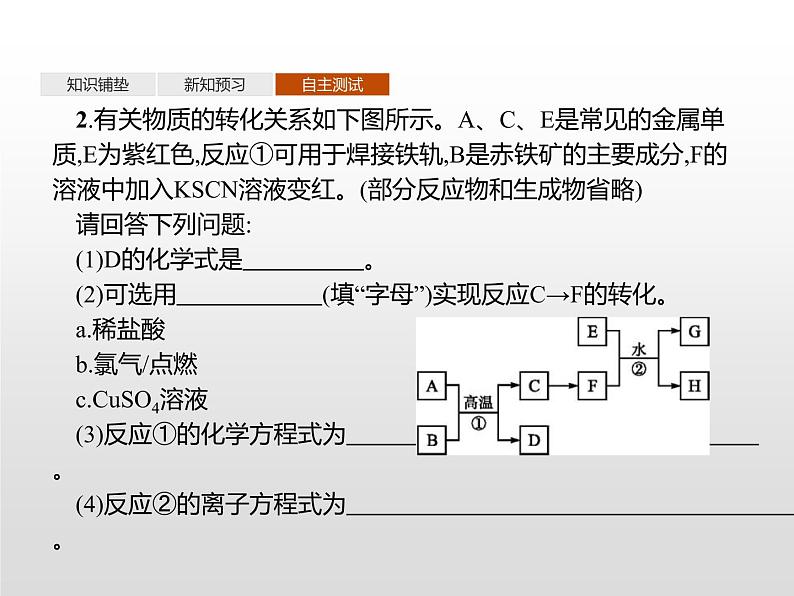
2.有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)请回答下列问题:(1)D的化学式是 。 (2)可选用 (填“字母”)实现反应C→F的转化。 a.稀盐酸b.氯气/点燃c.CuSO4溶液(3)反应①的化学方程式为 。 (4)反应②的离子方程式为 。
补铁剂中铁元素价态的检验问题探究1.补铁剂所含铁盐中铁元素的价态有几种可能?提示:Fe2+、Fe3+、Fe2+和Fe3+。2.如何验证某补铁剂溶液中含Fe2+而不含Fe3+?提示:验证某补铁剂中含Fe2+而不含Fe3+,可以根据检验亚铁离子的方法完成:取少量溶液置于试管中,先加几滴硫氰酸钾溶液,溶液不变为红色,证明补铁剂中不含Fe3+。另取补铁剂加过量氧化剂(补铁剂中存在较多的抗氧化物质如维生素C等),再加过量硫氰酸钾溶液,溶液变红色,证明补铁剂中含有Fe2+。
知识归纳(1)若溶液中只存在Fe2+,加入氢氧化钠溶液,溶液中出现白色沉淀并迅速变成灰绿色,最后变成红褐色。若同时存在Fe3+,加入氢氧化钠溶液生成红褐色沉淀,会掩盖Fe2+的检验。故溶液中有Fe2+和Fe3+同时存在时不能用氢氧化钠溶液检验Fe2+。(2)检验某未知溶液中是否含Fe2+时,不能先滴加氯水,后滴加KSCN溶液。因为若未知溶液中含有Fe3+,滴加KSCN溶液时,溶液变成红色,会干扰Fe2+的检验。
典例剖析例1一个体重50 kg的健康人体内含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在,Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1)试剂1是 。 (2)加入试剂2和新制氯水后溶液中发生反应的离子方程式为 。 (3)加入试剂2时溶液为淡红色说明“速力菲”中的Fe2+已部分氧化,一般在服用“速力菲”时,同时服用Vc,说明Vc具有 性。不仅溶液中Fe2+易被氧化成Fe3+,碱性环境中Fe(OH)2更易被O2氧化,请写出反应的化学方程式 。
(4)在实验中发现放置一段时间,溶液颜色会逐渐褪去,为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。 。
(4)取少量褪色后溶液置于试管中,并滴入足量的KSCN溶液,若溶液显红色,则乙同学猜想正确,若不显红色,则乙同学猜想不正确
解析:(1)根据“琥珀酸亚铁不溶于水但能溶于人体中的胃酸”,用盐酸溶解琥珀酸亚铁,所以试剂1是盐酸。(2)根据溶液变红色,加入的试剂2是KSCN溶液,加入新制氯水后溶液变红,说明Fe2+被氧化为Fe3+,反应的离子方程式是2Fe2++Cl2 === 2Fe3++2Cl-、Fe3++3SCN- === Fe(SCN)3;(3)维生素C可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+是氧化剂,维生素C是还原剂,则维生素C具有还原性;碱性环境中Fe(OH)2被O2氧化为Fe(OH)3,反应的化学方程式是4Fe(OH)2+O2+2H2O === 4Fe(OH)3;(5)取少量褪色后溶液置于试管中滴入足量的KSCN溶液,若溶液显红色,则乙同学猜想正确,若不显红色,则乙同学猜想不正确。
对点训练1在探究某补铁剂中铁元素价态的实验中,老师取一片该补铁剂用盐酸溶解,经脱色过滤后,得到250 mL近乎无色的溶液,继续加入1滴液溴(已知Br2和Cl2的性质相似),振荡,溶液变为黄色。(1)甲同学认为这不是发生化学反应所致,因Br2水本就呈棕黄色,使溶液变黄色的物质是Br2。乙同学认为这是发生化学反应所致,使溶液变黄色的物质是 (填粒子的化学式),发生反应的离子方程式为 。
(2)现提供以下试剂:A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰酸钾溶液。请你用两种方法支持乙同学,写出选用的试剂编号及实验中应观察到的现象:(3)补铁剂中铁元素含量的测定通常使用到双氧水,请写出将双氧水滴入该补铁剂用酸溶解并经脱色后的溶液中发生反应的离子方程式 。
解析:(1)乙同学认为这是发生化学反应所致,溴单质具有强氧化性,能够将亚铁离子氧化成铁离子,反应的离子方程式为2Fe2++Br2 === 2Fe3++2Br-;(2)溴易溶于四氯化碳中而不易溶于水中,且四氯化碳与水不溶,根据四氯化碳层颜色判断,若有机层为橙红色,乙同学观点不成立,若有机层为无色,则说明使溶液呈黄色的物质不是溴,乙同学观点成立;Fe3+遇KSCN溶液变为红色,向溶液中滴加硫氰酸钾溶液后,溶液呈红色,则说明使溶液呈黄色的物质是铁离子。(3)H2O2具有氧化性,可将Fe2+氧化为Fe3+。
含铁元素物质之间的转化问题探究1.含有同种价态铁元素的物质之间通过什么类型的反应相互转化?含有不同价态铁元素的物质可以通过什么反应相互转化?提示:含有同种价态铁元素的物质之间可以通过复分解反应相互转化,含有不同价态铁元素的物质可以通过氧化还原反应转化。
2.利用铁及其化合物之间的转化关系可以解决哪些问题?提示:(1)离子共存问题Fe2+在酸性条件下不能与强氧化性离子大量共存;Fe3+不能与还原性离子大量共存,如:I-、S2-、 等。不能与OH-、SCN-等大量共存。(2)分离与提纯①FeCl2(杂质FeCl3),加入铁钉或铁粉后过滤。②FeCl3(杂质FeCl2),通入Cl2或滴加氯水或加入“绿色”氧化剂H2O2(2Fe2++H2O2+2H+ === 2H2O+2Fe3+)。(3)溶液的配制与保存
知识归纳Fe、Fe2+、Fe3+之间的相互转化
易错提醒(1)溶液中Fe3+与Cu等不活泼金属反应时,Fe3+只能转化为Fe2+。 (2)溶液中Fe3+与较活泼金属如Zn、Al等反应时,金属单质足量时:Fe3+→Fe2+→Fe,金属单质不足时:Fe3+→Fe2+。
典例剖析例2下列框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物。G遇KSCN溶液显红色。
请填写下列空白。(1)上述5个反应中,既属于氧化还原反应又属于化合反应的是 (填序号)。 (2)反应⑤的化学方程式为 。 (3)甲与B反应的离子方程式为 。 (4)在实验室将C溶液滴入F溶液中,观察到的现象是 。 (5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为 。
解析:框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,则B应是水,A为淡黄色固体,则A是过氧化钠,所以甲和乙应该是钠和氧气。过氧化钠和水反应生成氢氧化钠和氧气,则乙是氧气,甲是钠,C是氢氧化钠。F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色,所以G是氯化铁,氢氧化钠与氯化铁反应生成氢氧化铁,E是氢氧化铁,D与氧气、水反应生成E,所以D是氢氧化亚铁,则F是氯化亚铁。(1)根据以上分析可知题中既属于氧化还原反应又属于化合反应的是①和⑤。
(2)反应⑤的化学方程式为4Fe(OH)2+O2+2H2O === 4Fe(OH)3。(3)钠与水反应的离子方程式为2Na+2H2O === 2Na++2OH-+H2↑。(4)在实验室将氢氧化钠溶液滴入氯化亚铁溶液中,观察到的现象是产生白色沉淀,迅速变为灰绿色,最终变为红褐色沉淀。(5)由于过氧化钠具有强氧化性,可以把亚铁离子氧化并最终转化为氢氧化铁沉淀,则根据原子守恒和电荷守恒以及电子得失守恒可知发生反应的总的离子方程式为4Fe2++4Na2O2+6H2O === 4Fe(OH)3+8Na++O2↑。
对点训练2元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是( )
A.铁与高温水蒸气的反应可实现上述转化①B.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末C.转化⑦发生反应的类型是化合反应D.加热Fe(OH)3发生转化⑥,加水溶解可实现转化③
答案:C解析:铁与高温水蒸气的反应不能实现题中转化①,A项错误;FeO是一种黑色粉末,不稳定,在空气中受热,部分被氧化,氧化生成Fe3O4,B项错误;转化⑦发生反应的化学方程式为4Fe(OH)2+O2+2H2O === 4Fe(OH)3,属于化合反应,C项正确;加热Fe(OH)3发生转化⑥分解生成氧化铁,氢氧化铁不溶于水,加水溶解不可实现转化③,D项错误。
1.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )A.苹果汁中的Fe2+变成Fe3+B.苹果汁中含有Cu2+C.苹果汁含有OH-D.苹果汁含有Fe3+答案:A解析:苹果中含有Fe2+,把苹果榨成苹果汁之后,果汁中的Fe2+被空气中的氧气氧化成Fe3+。
2.下列叙述不正确的是( )
答案:D解析:A项发生反应:2FeCl2+Cl2 === 2FeCl3,正确;B项发生反应:Fe+2FeCl3 === 3FeCl2,正确;C项银与盐酸不反应,而Fe与盐酸反应,正确;D项混合物在空气中灼烧时,Fe(OH)2最终转变为Fe2O3,错误。
3.下列说法正确的是( )A.Fe在一定条件下与水反应生成H2和Fe(OH)3B.Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液不会显红色C.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁D.Fe3+具有氧化性,据此可用KSCN溶液鉴别Fe3+答案:C解析:高温下铁能与水蒸气反应生成Fe3O4和H2,故A项错误;Fe3O4溶于盐酸生成Fe3+和Fe2+,Fe3+与KSCN反应得到红色溶液,故B项错误;一般炼铁的过程就是用CO还原Fe2O3生成Fe,故C项正确;用KSCN溶液鉴别Fe3+主要是利用了Fe3+与KSCN溶液反应显示红色,而非Fe3+的氧化性,故D项错误。
4.将过量Na2O2投入FeCl2溶液中,可观察到的现象是 ( )A.有白色沉淀生成B.有红褐色沉淀生成C.溶液由浅绿色变为黄色D.不可能有无色气体产生答案:B解析:首先发生反应2Na2O2+2H2O === 4NaOH+O2↑,然后发生反应Fe2++2OH- === Fe(OH)2↓、4Fe(OH)2+O2+2H2O === 4Fe(OH)3,即生成红褐色沉淀,且有无色气体(O2)生成。
5.若下图所示实验均进行合理的操作。回答相关问题:(1)①中两溶液混合后,观察到的现象为 。写出相关反应的化学方程式或离子方程式 。(2)②中加入苯的作用是 。 (3)或要持续较长时间地看到产生的白色Fe(OH)2沉淀,③所示装置进行的操作为 。
高中鲁科版 (2019)第1节 铁的多样性教课内容课件ppt: 这是一份高中鲁科版 (2019)<a href="/hx/tb_c4002547_t3/?tag_id=26" target="_blank">第1节 铁的多样性教课内容课件ppt</a>,共14页。PPT课件主要包含了微量元素,+2价,+3价,维生素C等内容,欢迎下载使用。
2020-2021学年第3章 物质的性质与转化第1节 铁的多样性图文课件ppt: 这是一份2020-2021学年第3章 物质的性质与转化第1节 铁的多样性图文课件ppt,共14页。PPT课件主要包含了微量元素,+2价,+3价,维生素C等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第1节 铁的多样性备课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第1节 铁的多样性备课课件ppt,共44页。PPT课件主要包含了课前篇素养初探,知识铺垫,必备知识,正误判断,课堂篇素养提升,问题探究,深化拓展,典例剖析等内容,欢迎下载使用。













