






2021学年第二节 碱及其性质备课ppt课件
展开一、常见的碱1.碱的定义溶于水后产生共同的阴离子——________________的化合物。
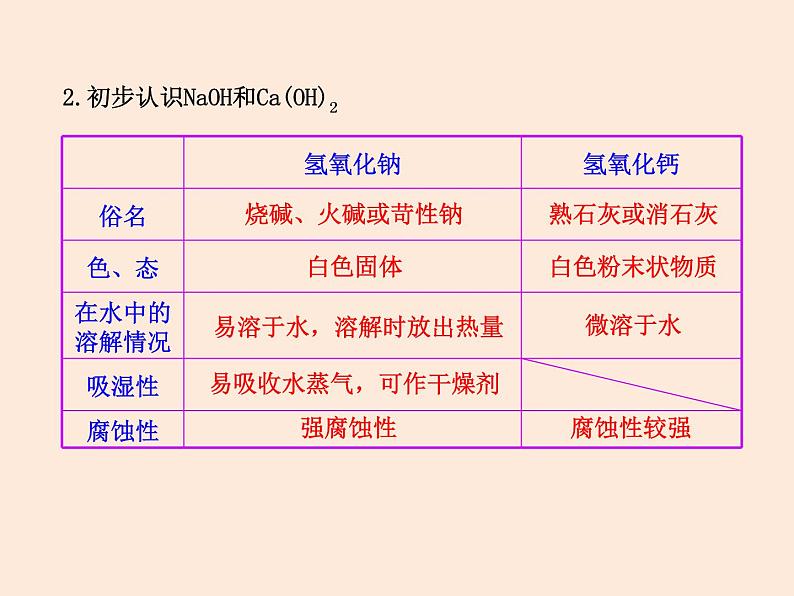
2.初步认识NaOH和Ca(OH)2
易溶于水,溶解时放出热量
易吸收水蒸气,可作干燥剂
3.烧碱的使用注意事项(1)暴露在空气中易吸收水蒸气而逐渐溶解,因此应________。(2)使用时必须十分小心,防止眼睛、皮肤、衣服等被腐蚀。若不慎沾到皮肤上,应立即_____________,然后再涂上_____溶液。4.氢氧化钙的制取工业上通过高温煅烧石灰石制取生石灰,再用生石灰和水反应来制取。化学方程式分别为________________________、___________________(反应放出大量的热)。
CaCO3 CaO+CO2↑
CaO+H2O====Ca(OH)2
二、碱的化学性质1.实验探究NaOH、Ca(OH)2的化学性质(1)和石蕊试液、酚酞试液的作用
(2)和生锈铁钉、CuCl2溶液、Na2CO3溶液的作用①实验现象
②相关化学反应方程式a.氢氧化钠、氢氧化钙分别与氯化铜溶液反应的化学方程式为________________________________、____________________________________。b.氢氧化钙溶液与碳酸钠溶液反应的化学方程式:_________________________________。
2NaOH+CuCl2====Cu(OH)2↓+2NaCl
Ca(OH)2+CuCl2====
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
Cu(OH)2↓+CaCl2
(3)和二氧化碳的反应。①实验过程向2个盛有CO2气体的矿泉水瓶里分别加入少量NaOH溶液和Ca(OH)2溶液,立即盖紧并振荡,可观察到_________。②相关的化学方程式________________________,___________________________
2NaOH+CO2====Na2CO3+H2O
Ca(OH)2+CO2====CaCO3↓+H2O
2.碱的通性及特性(1)碱的通性。①碱具有相似化学性质即碱的通性的原因是碱溶液中都含有___________。②碱的通性a.能使紫色石蕊试液_____,使无色酚酞试液_____。b.能与某些非金属氧化物反应,生成_______。c.能与某些盐反应生成_________和_________。
(2)Ca(OH)2溶液的特性。Ca(OH)2溶液能与Na2CO3溶液反应,而NaOH却不能。
【判断抢答】1.生石灰、熟石灰、消石灰的成分都是氢氧化钙。( )提示:生石灰的成分是氧化钙,熟石灰和消石灰的成分是氢氧化钙。2.NaOH属于碱类物质,可以治疗胃酸(含HCl)过多。( )提示:氢氧化钠属于碱类物质,但具有较强的腐蚀性,不可用作内服药物。
3.盛有石灰水的试剂瓶应密封,盛放NaOH的试剂瓶可敞口放置。( )提示:氢氧化钠能与空气中的二氧化碳反应,也具有吸水性,故也应密封保存。4.NaOH与Ca(OH)2化学性质相似的原因是溶液中都含有OH-。( )提示:碱类物质具有相似化学性质的原因是溶液中都含有OH-。5.NaOH溶液能与CuCl2溶液发生复分解反应生成白色沉淀。( )提示:NaOH溶液和CuCl2反应能生成蓝色的氢氧化铜沉淀,不是白色的。
【探究点】验证氢氧化钠与二氧化碳是否反应的探究实验有些化学反应必须借助一定的装置来判断反应是否发生。在探究CO2和NaOH是否发生化学变化时,某校化学探究小组的同学设计了以下四种实验装置,结合下图装置探究相关问题:
1.简述上述四种装置会发生的现象,上述四种装置设计的共同原理是什么?提示:A中的现象为试管内液面上升;B中的现象为软塑料瓶变扁了;C中的现象为鸡蛋进入到了瓶内;D中的现象为气球鼓起。二氧化碳与氢氧化钠反应,使容器内气体压强减小,与外界大气压形成压强差。
2.同学们经过分析讨论,认为A组的实验中产生现象的原因可能有两种。一种是因为CO2与溶液中的NaOH反应,消耗了CO2,你认为另一种原因是什么,如何证实CO2与NaOH溶液已经发生了反应?(提示:Na2CO3性质与CaCO3相似)提示:另一种原因是CO2与溶液中的水反应消耗了CO2,第一组同学可以在反应后的溶液中滴加足量的稀盐酸,现象为有气泡产生; 第二组同学可以在反应后的溶液中滴加氯化钙溶液,现象为产生白色沉淀。
3.检验CO2时为什么用Ca(OH)2溶液而不用NaOH溶液?吸收或除去CO2时为什么用NaOH溶液而不用Ca(OH)2溶液?提示:CO2与Ca(OH)2溶液反应后有白色浑浊现象,而CO2与NaOH溶液反应没有明显现象;氢氧化钙微溶于水,溶液中含氢氧化钙的量比较少,只能吸收少量的二氧化碳,而氢氧化钠易溶于水,可以充分吸收二氧化碳。
【典型例题】将CO2通入NaOH溶液中无明显现象。某学习小组的同学为了观察到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列相关实验。请根据实验过程及内容,思考并回答相关问题。
(1)实验装置如图甲所示。将整套装置(包括CO2及NaOH溶液)放在天平上称量,测得质量为78.2 g。(2)用力推压注射器活塞向密闭的软塑料瓶中注入10 mL NaOH溶液(装置如图乙所示),振荡后观察到的现象有________________________________________________________________。 (3)静置片刻后,将整套装置再次放在天平上称量,测得其质量仍为78.2 g,你对这一结果的解释是________________________________________________________________________。
(4)通过上述探究实验,你得到的启示是:①若采用有气体参加或生成的反应来验证质量守恒定律,应让化学反应在________中进行。②为进一步证明CO2与NaOH溶液确实已经发生了化学反应,你还能想到的方法是_____________________________________。
【易错提醒】1.氢氧化钠与二氧化碳反应,会使容器内压强减小。2.验证质量守恒定律时,有气体参与的化学反应需要在密闭容器中进行。
提示:(2)氢氧化钠溶液进入软塑料瓶后,CO2与NaOH溶液发生反应,使瓶内压强减小,会造成软塑料瓶变瘪,注射器中的氢氧化钠溶液会自动流入塑料瓶。(3)由于整套装置是密闭的,反应过程中没有物质进入,反应前后装置质量相等,能验证质量守恒定律。(4)用有气体参加或生成的反应来验证质量守恒定律时,装置一定要密闭;由于二氧化碳能溶于水,此实验无法证明NaOH与CO2一定发生了反应。但可以用检验反应后的溶液中有Na2CO3的方法,说明NaOH与CO2确实发生了反应,如用稀盐酸、BaCl2溶液等。
答案:(2)塑料瓶变瘪,注射器中剩余溶液自动进入塑料瓶中(3)反应容器密闭,生成物全部留在瓶内,也没有空气进入,因而反应前后质量相等(即质量守恒)(4)①密闭容器 ②向反应后的溶液中加入足量稀盐酸,有气泡产生(或其他合理答案)
1.结合所学的知识,将下图中碱的有关性质及反应规律在图中填写完整。
提示:碱能使石蕊试液变蓝,使无色酚酞变红,与非金属氧化物反应生成盐和水;与盐发生复分解反应生成一种新的盐和一种新的碱。
2.物质分类是学生应掌握的基本知识,若①代表单质②代表化合物 ③代表酸 ④代表碱 ⑤代表氧化物⑥代表盐,根据你所学过的知识,将对应的序号填入下图。
2021学年第二节 碱及其性质背景图ppt课件: 这是一份2021学年第二节 碱及其性质背景图ppt课件,共51页。PPT课件主要包含了苛性钠,消石灰,白色固体,白色粉末状物质,水蒸气,干燥剂,密封保存,用大量水冲洗,无变化,生成蓝色沉淀等内容,欢迎下载使用。
初中鲁教版第四节 酸碱中和反应备课课件ppt: 这是一份初中鲁教版第四节 酸碱中和反应备课课件ppt,共18页。
初中化学鲁教版九年级下册第二节 碱及其性质评课课件ppt: 这是一份初中化学鲁教版九年级下册第二节 碱及其性质评课课件ppt,共28页。PPT课件主要包含了几种物质,CO2,H2O,CaCO3,CaOH2,CaO,钙三角,与酸碱指示剂反应,澄清石灰水变浑浊,与某些盐反应等内容,欢迎下载使用。













