

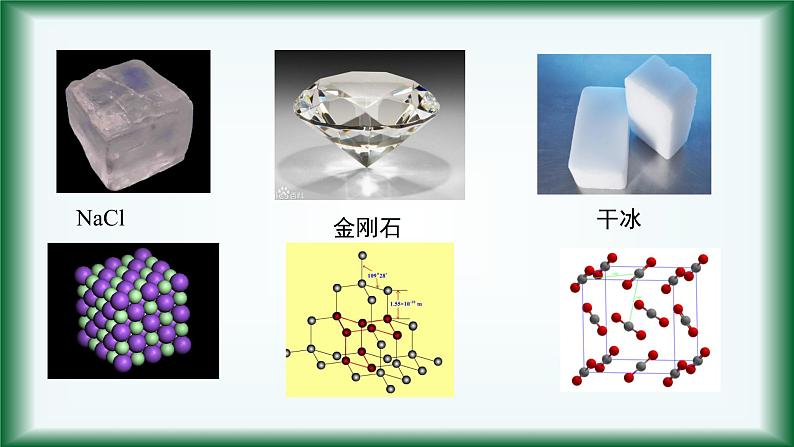



2020-2021学年第四章 物质结构 元素周期律第三节 化学键课文配套课件ppt
展开1、定义:物质中直接相邻的原子或离子之间强烈的相互作用,叫做化学键。
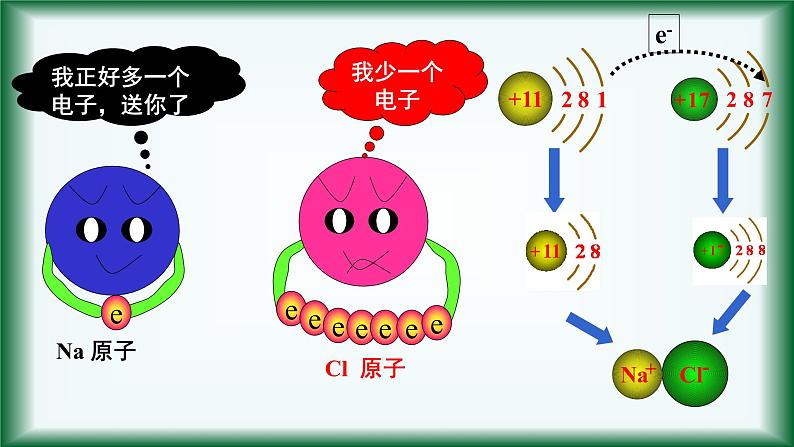
从微观角度分析,氯化钠是怎么形成的?
我正好多一个电子,送你了
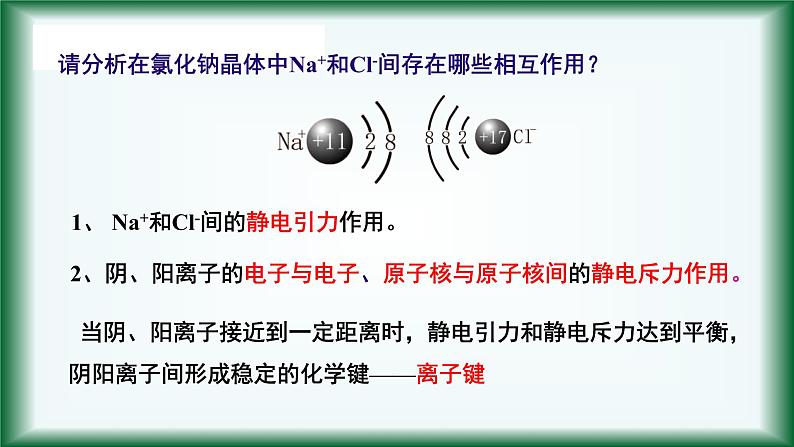
请分析在氯化钠晶体中Na+和Cl-间存在哪些相互作用?
1、 Na+和Cl-间的静电引力作用。
2、阴、阳离子的电子与电子、原子核与原子核间的静电斥力作用。
当阴、阳离子接近到一定距离时,静电引力和静电斥力达到平衡,阴阳离子间形成稳定的化学键——离子键
定义:阴阳离子间通过静电作用所形成的化学键叫做离子键。
静电作用(吸引与排斥)
活泼金属元素与活泼非金属元素
哪些物质存在离子键?
含有离子键的化合物一定是离子化合物
金属与非金属不一定形成离子键,形成离子键的离子不一定有金属元素
通过熔融状态下的物质导电性实验可以证明离子的存在性
注意①:大多数含金属元素的化合物在熔融状态下能导电②:AlCl3在熔融状态下不能导电③:铵盐在熔融状态下可以导电④:纯净的硫酸和HCl不导电
离子化合物都是强电解质
H 和 Cl 原子形成HCl过程中,能否形成离子键?为什么?
HCl分子不是通过离子键来形成,是通过什么方式结合的呢?
不能,因非金属元素的原子均有获得电子的倾向。
我只有一个电子,太少了
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有,行吗?
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
1. 定义:原子间通过共用电子对所形成的相互作用
讨论:只有非金属间才能形成共价键?
同种或不同种非金属元素之间(一般)
哪些物质存在共价键?
1. 非金属单质(稀有气体除外)
4. 含有原子团的离子化合物
只含有共价键的化合物
成键的时候一定都是8电子稳定结构吗?
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子
1、元素的化学性质与什么有关?
3、有什么简便的方法表只表示原子或离子的最外层电子排布?
2、为了方便表示化学性质是否可以只表示最外层电子排布?
1. 原子的电子式:
在元素符号周围(上下左右)用“ · ”或“×”来表示原子最外层电子
练习:H C N O F Na Mg Al S Cl K Ca
2. 简单阳离子的电子式:
由于简单阳离子最外层电子已经失去,所以无最外层电子,即离子符号
练习:Na+ Mg2+ Al3+ K+ Ca2+ NH4+
3.简单阴离子的电子式
由于阴离子的形成是由原子得电子形成,最外层电子数满足达到2e-或8e-结构,需将最外层电子数表示出来,并用中括号 “ [ ] ” 括上,并写出所带电荷数
练习: O2- Cl- S2- OH-
4. 离子化合物电子式
①由阴阳离子电子式组成②相同离子不能合并,同性电荷不直接相邻
失去的莫挽留得到的需珍惜
用一条短线来表示原子间的一对共用电子对省略其余的电子
规律:缺少几个电子达到稳定结构,就共用几对电子
写出下列物质的电子式NH4Cl NaOH Na2O2 HClO H2O H2O2
可以用球棍模型、空间填充模型表示共价分子的空间结构。
球棍模型:小球半径大小表示原子半径大小。
思考1:原子或分子是二维还是三维立体的?
思考2:如何表示空间结构呢?
七、用电子式表示离子键和共价键的形成
A原子电子式 + B原子电子式→离子化合物
箭头表示电子转移方向,从失指向得
A原子电子式 + B原子电子式 →共价化合物
思考:化学反应的实质是什么?
答:旧键的断裂和新键的形成
高中化学人教版 (2019)必修 第一册第三节 化学键说课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键说课课件ppt,共18页。PPT课件主要包含了化学键,注意不包括分子,离子键,成键要素,阴阳离子,静电作用,②明显带离子的物质,2二个“不一定”,1三个“一定”,离子化合物等内容,欢迎下载使用。
高中人教版 (2019)第四章 物质结构 元素周期律第三节 化学键教课ppt课件: 这是一份高中人教版 (2019)第四章 物质结构 元素周期律第三节 化学键教课ppt课件,共34页。PPT课件主要包含了Cl-等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 化学键教课内容课件ppt: 这是一份人教版 (2019)必修 第一册第三节 化学键教课内容课件ppt,共19页。PPT课件主要包含了化学键,电子的转移,电子得失,共用电子对偏移,NaCl,HCl,Cl-,离子键,活泼金属化合物,电子式等内容,欢迎下载使用。













