初中化学鲁教版九年级下册第一节 酸及其性质学案设计
展开
这是一份初中化学鲁教版九年级下册第一节 酸及其性质学案设计,共4页。学案主要包含了课堂学习研讨,活动与探究,实践应用,延伸知识,课堂评价练习,课后拓展练习等内容,欢迎下载使用。
酸及其性质教学目标
知识:掌握盐酸、硫酸的化学性质及有关的化学方程式,了解其物理性质和用途。 能力:浓H2SO4的特性及稀释。 情感:通过展示样品及演示实验,培养学生的观察能力和分析实验现象的能力。 重点 、难点 盐酸、稀H2SO4的化学性质。
化学方程式的书写。
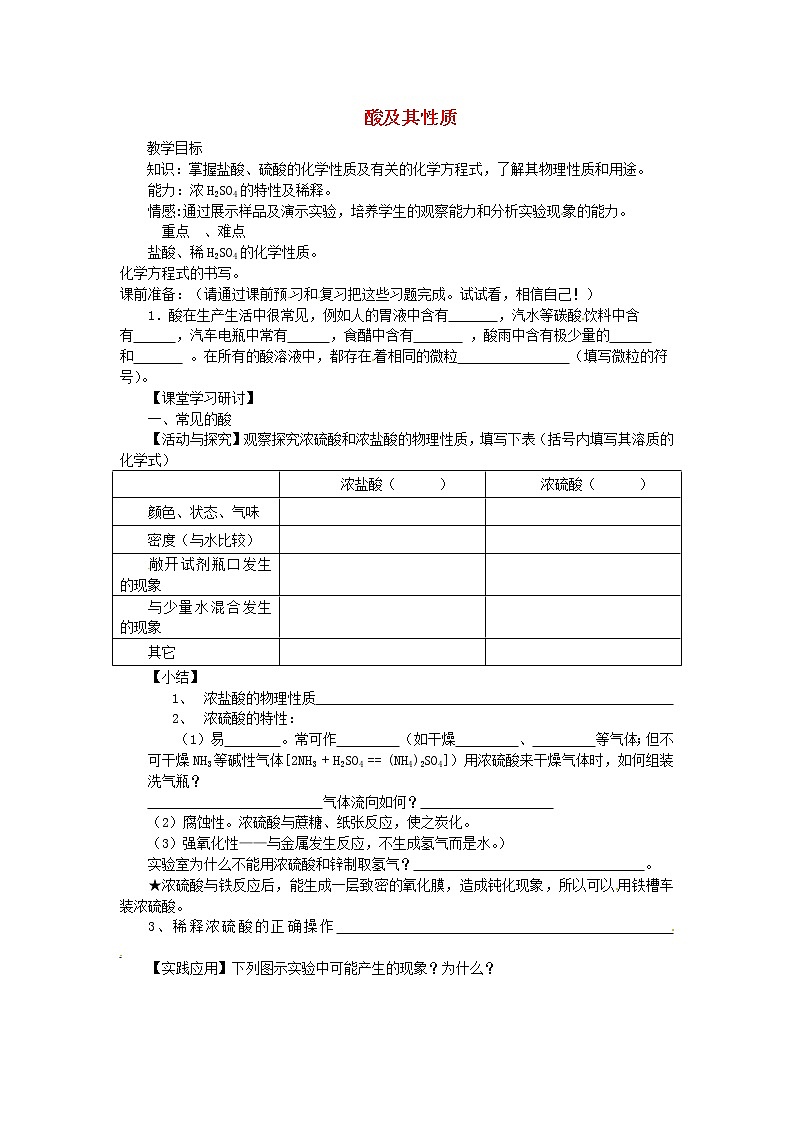
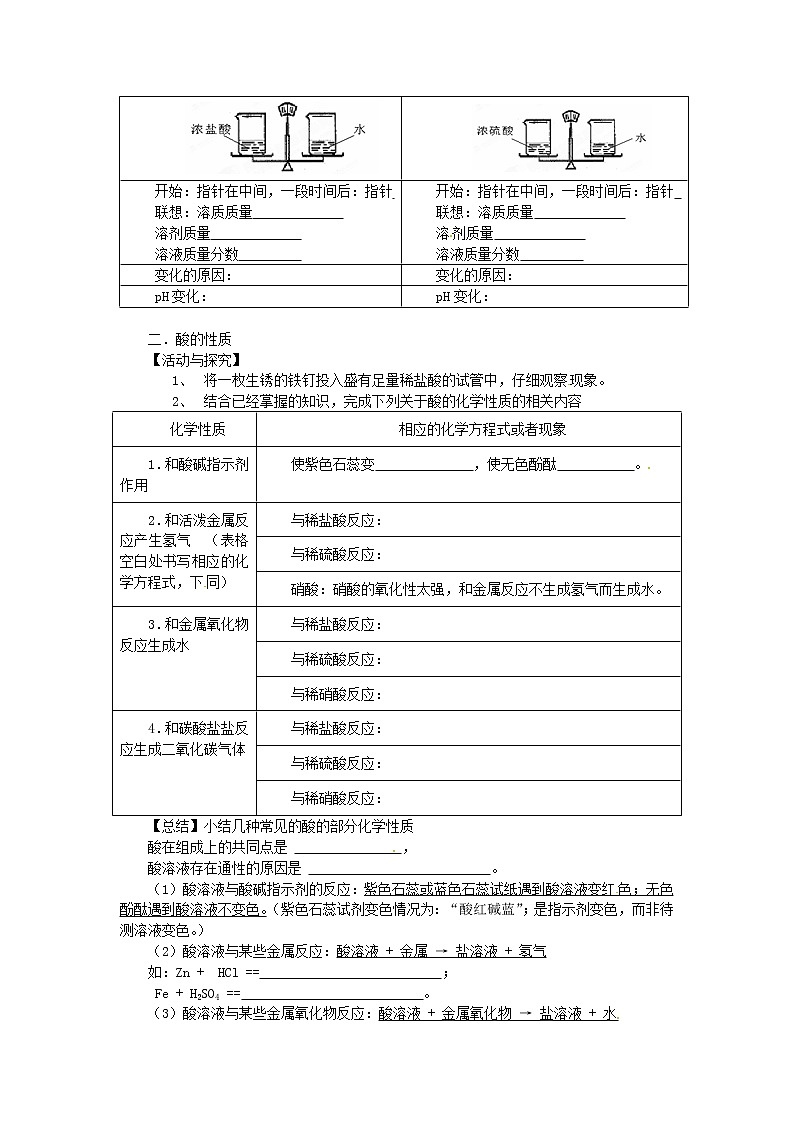
课前准备:(请通过课前预习和复习把这些习题完成。试试看,相信自己!)1.酸在生产生活中很常见,例如人的胃液中含有 ,汽水等碳酸饮料中含有 ,汽车电瓶中常有 ,食醋中含有 ,酸雨中含有极少量的 和 。在所有的酸溶液中,都存在着相同的微粒 (填写微粒的符号)。【课堂学习研讨】一、常见的酸【活动与探究】观察探究浓硫酸和浓盐酸的物理性质,填写下表(括号内填写其溶质的化学式) 浓盐酸( )浓硫酸( )颜色、状态、气味 密度(与水比较) 敞开试剂瓶口发生的现象 与少量水混合发生的现象 其它 【小结】1、 浓盐酸的物理性质 2、 浓硫酸的特性:(1)易 。常可作 (如干燥 、 等气体;但不可干燥NH3等碱性气体[2NH3 + H2SO4 == (NH4)2SO4])用浓硫酸来干燥气体时,如何组装洗气瓶? 气体流向如何? (2)腐蚀性。浓硫酸与蔗糖、纸张反应,使之炭化。(3)强氧化性——与金属发生反应,不生成氢气而是水。)实验室为什么不能用浓硫酸和锌制取氢气? 。★浓硫酸与铁反应后,能生成一层致密的氧化膜,造成钝化现象,所以可以用铁槽车装浓硫酸。3、稀释浓硫酸的正确操作 【实践应用】下列图示实验中可能产生的现象?为什么?开始:指针在中间,一段时间后:指针 联想:溶质质量 溶剂质量 溶液质量分数 开始:指针在中间,一段时间后:指针 联想:溶质质量 溶剂质量 溶液质量分数 变化的原因:变化的原因:pH变化:pH变化: 二.酸的性质【活动与探究】1、 将一枚生锈的铁钉投入盛有足量稀盐酸的试管中,仔细观察现象。2、 结合已经掌握的知识,完成下列关于酸的化学性质的相关内容化学性质相应的化学方程式或者现象1.和酸碱指示剂作用使紫色石蕊变 ,使无色酚酞 。2.和活泼金属反应产生氢气 (表格空白处书写相应的化学方程式,下同)与稀盐酸反应:与稀硫酸反应:硝酸:硝酸的氧化性太强,和金属反应不生成氢气而生成水。3.和金属氧化物反应生成水与稀盐酸反应:与稀硫酸反应:与稀硝酸反应:4.和碳酸盐盐反应生成二氧化碳气体与稀盐酸反应:与稀硫酸反应:与稀硝酸反应:【总结】小结几种常见的酸的部分化学性质酸在组成上的共同点是 ,酸溶液存在通性的原因是 。(1)酸溶液与酸碱指示剂的反应:紫色石蕊或蓝色石蕊试纸遇到酸溶液变红色;无色酚酞遇到酸溶液不变色。(紫色石蕊试剂变色情况为:“酸红碱蓝”;是指示剂变色,而非待测溶液变色。)(2)酸溶液与某些金属反应:酸溶液 + 金属 → 盐溶液 + 氢气如:Zn + HCl == ; Fe + H2SO4 == 。 (3)酸溶液与某些金属氧化物反应:酸溶液 + 金属氧化物 → 盐溶液 + 水注意:该反应过程中,金属元素的化合价 ,酸中的原子团不变。如:CuO + HCl == ZnO + HNO3 ==Fe2O3 + H2SO4 == (4)酸溶液与某些盐反应:酸溶液 + 盐 → 新酸+ 新盐如:CaCO3 + HCl == Na2CO3 + H2SO4 == Na2CO3+ HCl == K2CO3 + HNO3 == HCl + AgNO3 == BaCl2 + H2SO4 ==。 【延伸知识】Cl—及SO42-的检验A.向待测溶液中加入AgNO3溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有Cl-,如果没有沉淀或者沉淀消失,则不含有Cl-。B.向待测溶液中加入Ba(NO3)2溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有SO42-,如果没有沉淀或者沉淀消失,则不含有SO42-。【课堂评价练习】 1.人体内的胃液里含有少量的酸,该酸是() A.硫酸 B.碳酸 C.醋酸 D.盐酸2. 实验室制H2和CO2(用大理石)都可以使用的酸是()A.浓硫酸 B.稀硝酸 C.稀硫酸 D.稀盐酸3.下列说法不正确的是() A.打开浓盐酸的试剂瓶,瓶口有白雾冒出 B.盐酸和铁粉反应后溶液呈黄色C.盐酸使紫色石蕊试液变红色 D.盐酸可除去铁制品表面的锈4.下列化学方程式正确的是() A.2Fe + 6HCl == 2FeCl3 + 3H2↑ B.Fe2O3 + 4HCl == 2FeCl2 + 3H2O C. Na2CO3 + 2HNO3 == 2NaNO3 + H2O + CO2↑ D.Zn + 2HNO3 == Zn(NO3)2 + H2↑5. 下列物质①FeCl3 ②ZnCl2 ③CuCl2 ④AlCl3中,能用金属和盐酸直接反应制得的物质是 ( ) A. ①② B.②④ C. ③④ D. ①③ 6. 酸都具有某些共同的性质,主要决定于() A.与指示剂作用 B.都含有氢元素C.都能电离出相同的H+ D.都能使紫色石蕊试液变红7.下列溶液加热蒸发时,溶质的质量分数可能会降低的是()A.食盐溶液 B.浓盐酸 C.稀硫酸 D.硝酸钾溶液 8.将生锈的铁钉投入盐酸中,稍微热,观察到溶液 (填颜色变化情况),该反应的化学方程式是 ;继续观察可以看到铁钉表面有 放出,反应的化学方程式为 。10. 烧水的铝壶中经常结有一层水垢(水垢的主要成分是碳酸钙和氢氧化镁),用适量的稀盐酸可以除去它,写出反应的化学方程式 、 ;【课后拓展练习】 1.下列几种溶液久置于空气中,溶质成分不变,但溶质的质量分数减小且溶液质量增加的是 ( ) A. 浓硫酸 B. 浓盐酸 C. 浓硝酸 D. 石灰水2.请用实验探究:盐酸溶液中哪一种粒子(H2O、H+、Cl-)能使指示剂变色?实验步骤: ①在第一支试管中加入约2 mL蒸馏水,滴入几滴紫色石蕊试液,观察现象。 ②在第二支试管中加入约2 mL NaCl溶液(pH=7),滴入几滴紫色石蕊试液,观察现象。 ③在第三支试管中加入约2 mL HCl溶液,滴入几滴紫色石蕊试液,观察现象。 通过上述实验,回答下列问题(下述“现象”是指紫色石蕊试液是否变色): 实验①看到的现象是 ,你得出的结论是 ; 实验②看到的现象是 ,你得出的结论是 ;实验③看到的现象是 ,你得出的结论是 。4.有失去标签的的浓盐酸和的浓硫酸各一瓶,请用不同的方法将他们区分开: 物理方法:________________________________________________。 化学方法:_______________________________________________。
相关学案
这是一份初中化学鲁教版九年级下册第一节 酸及其性质导学案,共3页。学案主要包含了学习目标,学习过程,课堂练习等内容,欢迎下载使用。
这是一份初中化学鲁教版九年级下册第四节 酸碱中和反应学案设计,共3页。学案主要包含了课前准备,导入新课,演示实验,问题发现,交流与讨论,问题呈现,归纳小结,实验 1等内容,欢迎下载使用。
这是一份化学鲁教版第七单元 常见的酸和碱第二节 碱及其性质学案设计,共3页。学案主要包含了学习目标,学习过程,课堂展评等内容,欢迎下载使用。










