




人教版 (2019)必修 第一册第二节 元素周期律优秀课件ppt
展开元素周期律元素的性质随着元素核电荷数(原子序数)的递增而呈周期性变化的规律叫元素周期律
元素周期律的实质:元素周期律是元素原子的核外电子排布的周期性变化的必然结果
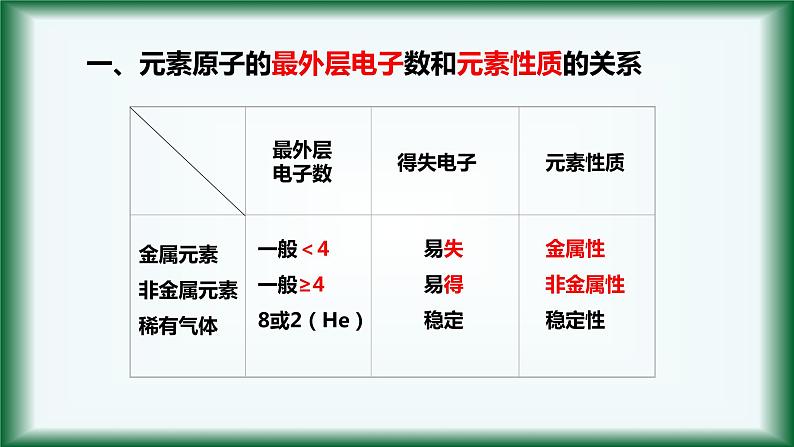
一、元素原子的最外层电子数和元素性质的关系
金属元素非金属元素稀有气体
一般<4一般≥48或2(He)
失去电子的能力(还原性)
如何比较金属性的强弱?
失去电子的难易程度,谁更容易失去电子,金属性就越强
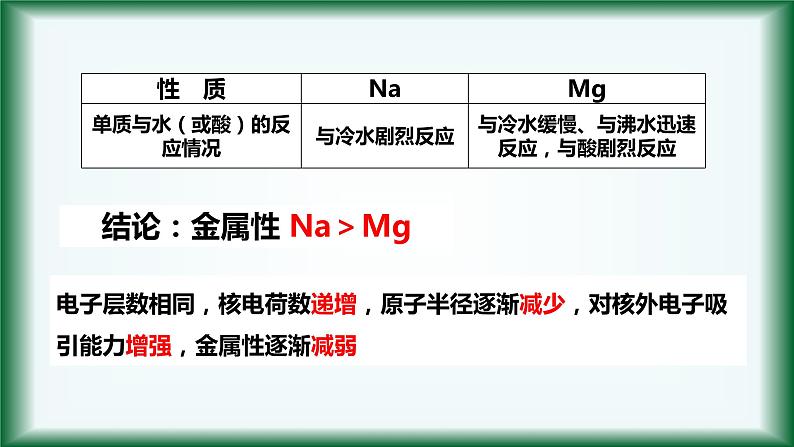
【实验探究】:钠、镁性质的递变
结论:金属性 Na>Mg
电子层数相同,核电荷数递增,原子半径逐渐减少,对核外电子吸引能力增强,金属性逐渐减弱
(2)根据11∽17号元素最高价氧化物的水化物的酸硫性强弱的变化规律,预测Al(OH)3可能具有的性质哪些?
两支试管中的白色胶状沉淀均溶解
Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,是两性氢氧化物。
Al(OH)3 + 3H+= Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
Al(OH)3是两性氢氧化物
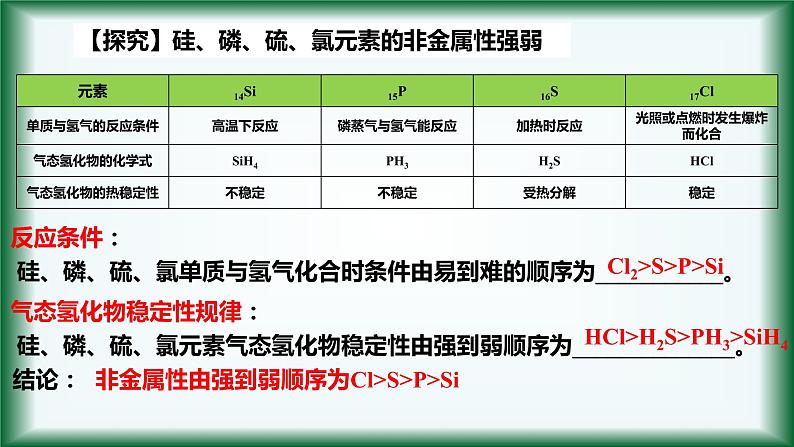
【探究】硅、磷、硫、氯元素的非金属性强弱
硅、磷、硫、氯单质与氢气化合时条件由易到难的顺序为___________。
气态氢化物稳定性规律:
硅、磷、硫、氯元素气态氢化物稳定性由强到弱顺序为______________。
Cl2>S>P>Si
HCl>H2S>PH3>SiH4
非金属性由强到弱顺序为Cl>S>P>Si
如何比较非金属性的强弱?
得到电子的难易程度,谁更容易得到电子,非金属性就越强
根据11-17号元素最高价氧化物的水化物的酸碱性强弱,探究元素的金属性和非金属性的强弱变化规律。
(1)11~17号元素最高价氧化物的水化物的酸碱性强弱的变化规律是_______________________________(2)11~17号元素的金属性和非金属性强弱的变化规律是____________________________________________________________________________
HClO4>H2SO4>H3PO4 >H2SiO3
元素原子的核外电子层数相同时,随着核电荷数逐渐增加,金属性逐渐减弱,非金属性逐渐增强。
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
二、元素金属性强弱的判断方法
如:氧化性:Ag+>Cu2+,则金属性:Ag
如:还原性:S2->Cl-,则非金属性:S
1.下列有关性质的比较中正确的是( )。 A.碱性:NaOH
2.2019年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为1-18号元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:W
3.短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )。
A.氢化物沸点:W
高中化学人教版 (2019)必修 第一册第二节 元素周期律授课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律授课课件ppt,共34页。PPT课件主要包含了知识回顾,原子结构分析,核电荷数,性质分析,周期性,原子半径,微粒半径大小,与冷水反应剧烈,中强碱,两性氢氧化物等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律试讲课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律试讲课ppt课件,共15页。PPT课件主要包含了核电荷数,电中性,带Z个正电荷,N个不带电,原子核,核外电子,带Z个负电荷,Z个正电荷,质子数,核外电子数等内容,欢迎下载使用。
2021学年第四章 物质结构 元素周期律第二节 元素周期律公开课课件ppt: 这是一份2021学年第四章 物质结构 元素周期律第二节 元素周期律公开课课件ppt,文件包含42元素周期律ppt、探究第三周期元素性质的递变mp4等2份课件配套教学资源,其中PPT共9页, 欢迎下载使用。













