






高中化学人教版 (2019)必修 第一册第一节 铁及其化合物课文课件ppt
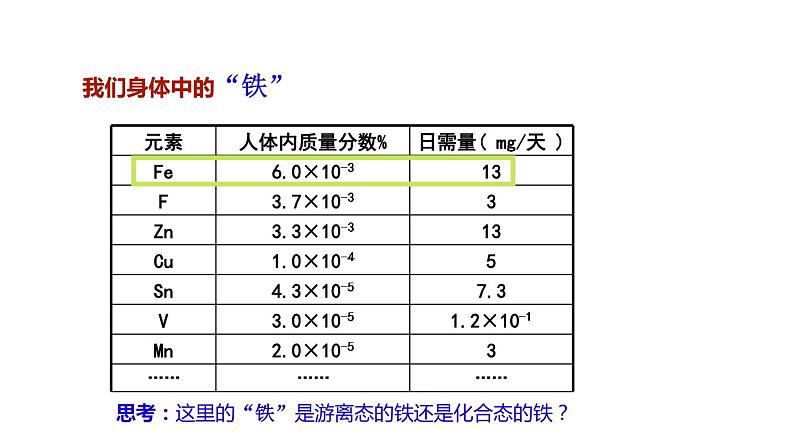
展开思考:这里的“铁”是游离态的铁还是化合态的铁?
亚铁盐:组成中含有Fe 2+的盐。常见的亚铁盐有: FeSO 4、FeCl 2、Fe(NO 3) 2等
铁 盐:组成中含有 Fe3+ 的盐。常见的铁盐有: Fe 2(SO 4) 3、FeCl 3、Fe(NO 3) 3等
【学习任务一】铁盐和亚铁盐的性质
实验探究 微观辨析
FeCl2、FeCl3 部分物理性质:
展示实物 宏观辩识
以FeCl2、FeCl3为例,通过实验探究Fe2+和Fe3+的性质。
FeSO4溶液,FeCl3 溶液,NaOH溶液,酸性KMnO4溶液,氯水,0.1 ml • L KSCN (硫氰酸钾)溶液,KI 溶液,淀粉溶液,稀硫酸,铁粉, 锌片,铜片;
【实验3-2 】在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液。观察并记录现象。
Fe3+ + 3SCN- = Fe(SCN)3
结论:氯化铁溶液显黄色,滴加硫氰化钾溶液后,溶液显红色;氯化亚铁溶液显浅绿色,滴加硫氰化钾溶液后无变化
Fe2+和Fe3+均能与NaOH溶液反应生成氢氧化物沉淀
迅速变成灰绿色,最后变成红褐色
Fe3++3OH-=Fe(OH)3↓
Fe2++2OH-==Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O=4Fe(OH)3(红褐色)
验证FeCl2的还原性
FeCl2溶液(浅绿色)
即:有Fe3+产生
验证FeCl2的氧化性
Zn溶解, 溶液由浅绿色变为无色
验证FeCl3的氧化性
FeCl3溶液(黄色)
黄色色变为浅绿色FeCl2
Fe2++2OH-=Fe(OH)2↓
Fe2++Zn=Fe+Zn2+
Fe2++Cl2=Fe+2Cl-
铁盐和亚铁盐的性质小结:
Fe3++3OH-=Fe(OH)3↓
2Fe3++Zn=2Fe2++Zn2+
2Fe3++2I-=2Fe2+ +I2
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Fe=3Fe2+
【学习任务二】Fe3+与Fe2+的检验
性质应用 问题解决
通过已学知识,怎么检验溶液中的Fe3+、Fe2+?
提示:(1) 观察溶液颜色
(2) 加NaOH溶液。
Fe2+ 溶液为浅绿色(或绿色)溶液;Fe3+溶液为黄色液。
Fe2+ 溶液滴加NaOH溶液生成白色沉淀、迅速变成灰绿色,最后变为红褐色;Fe3+溶液滴加NaOH溶液生成红褐色沉淀。
Fe3+、Fe2+溶液分别稀释到几乎无色时,我们不但无发通过溶液颜色鉴别或检验它们。当分别滴加NaOH溶液后,两溶液几乎观察不到沉淀。即FeCl3和FeCl2稀溶液不宜用通过溶液颜色和加NaOH溶液的方法检验。
整合信息 提出问题
通过已学知识,如何检验稀溶液中的Fe3+、Fe2+?
实验探究 问题解决
提示:运用刚刚学习的Fe3+性质的特性。
小结:Fe3+、Fe2+的鉴别和检验
方法一:滴加KSCN溶液
方法二:滴加NaOH溶液
产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色
滴加到酸性高锰酸钾溶液中
可以用酸性高锰酸钾代替吗
1.把铁加入FeCl3 、CuCl2的混合液中,反应后铁有剩余,则反应后溶液中离子浓度最大的是( )A、Cu2+ B、Fe2+ C、Fe3+ D、Cl-
2.要证明某溶液中不含Fe3+而可能含有Fe2+ ,进行如下实验操作时最佳顺序为( )①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液A.①③ B. ③② C. ③① D. ①②③
3.如果在加入硫氰化钾后溶液出现血红色,则如何检验该原溶液中含有亚铁离子?
Cl2、Br2、H2O2、KMnO4(H+)等氧化剂
注意:亚铁盐要现配现用,防止被空气中的氧气氧化
【学习任务三】Fe3+与Fe2+之间的转化
Fe、Zn、Cu、S2-、I-、SO32-等还原剂
(2)除去下列溶液中所含杂质① FeCl2 (FeCl3):选用试剂 , ② FeCl3 (FeCl2):选用试剂 , 离子方程式:
思考:(1)实验室在配制Fe2+溶液时,为防止Fe2+被氧化,可加入什么试剂?
2Fe2+ +Cl2=2Fe3++2Cl-
2Fe2+ +2H++H2O2= 2Fe3++ 2H2O
③ FeCl2溶液 (CuCl2) 。
制作过程: 先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
Cu + 2Fe3+ = 2Fe2+ + Cu2+
利用覆铜板制作图案(课文P70)阅读“背景”资料
根据工业上制作印刷电路板的原理,我们可以利用覆铜板制作所需要的图案(如图3-12)。
【实验】取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象,并展示制作的图案。【思考与讨论】(1)在上述实验中,发生了什么化学反应,生成的主要产物是什么?请运用氧化还原反应的规律进行分析,并尝试写出反应的化学方程式。(2)为使使用后的“腐蚀液”能得到充分利用,如何处理使用后的“腐蚀液”?
2Fe3+ + Cu = 2Fe2+ + Cu2+
先加人适量的铁粉与废液中Cu2+反应,回收铜;再向废液中加人氯水等氧化剂,实现FeCl3溶液的再生。
4.阅读下列材料后,回答相应问题。铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。(1)人体中经常进行转化 ,A反应中Fe2+作________剂,B反应中Fe3+作________剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有________性。(2)新配制的FeCl2溶液应加入________以防止FeCl2转化为FeCl3,要除去FeCl3溶液中少量的FeCl2杂质,可向其中通入适量的_____。
(3)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。反应的离子方程式为__________________________。(4)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,这一处理过程可用两个离子方程式表示为____________________________,___________________;处理过程中需定期添加的原料是______。
Cu+2Fe3+===Cu2++2Fe2+
2Fe2++Cl2===2Fe3++2Cl-
Fe+2Fe3+===3Fe2+
(5)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:取少许未知试液于试管中 溶液呈红色(证明含有FeCl2),你认为此方案________(填“合理”或“不合理”),若不合理,如何改进:______________________________________________________________________________________。
取少量溶液,先加KSCN溶液,溶液不变红色,再加入氯水,溶液变成红色,则证明原溶液有Fe2+
高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第一节 铁及其化合物一等奖ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第一节 铁及其化合物一等奖ppt课件,共31页。PPT课件主要包含了内容索引,学习目标,活动方案,溶液变成红色,课堂反馈,干燥产生的氢气,NaOH溶液,防止Fe2+被氧化,Fe2+等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 铁及其化合物多媒体教学课件ppt: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物多媒体教学课件ppt,共24页。PPT课件主要包含了铁盐和亚铁盐等内容,欢迎下载使用。
化学人教版 (2019)第一节 铁及其化合物背景图课件ppt: 这是一份化学人教版 (2019)第一节 铁及其化合物背景图课件ppt,共26页。PPT课件主要包含了红褐色沉淀等内容,欢迎下载使用。













