


所属成套资源:人教部编版高中化学必修一同步精品课件
- 第四章第1节原子结构与元素周期表第1课时 课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 3 次下载
- 第四章第1节原子结构与元素周期表第2课时 课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 3 次下载
- 第四章第1节原子结构与元素周期表第3课时碱金属课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 3 次下载
- 第四章第2节元素周期律第3课时课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 4 次下载
- 第四章第1节原子结构与元素周期表单元复习课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 2 次下载
化学必修 第一册第一节 原子结构与元素周期表课文ppt课件
展开
这是一份化学必修 第一册第一节 原子结构与元素周期表课文ppt课件,共24页。PPT课件主要包含了卤族元素,原子结构与元素性质等内容,欢迎下载使用。
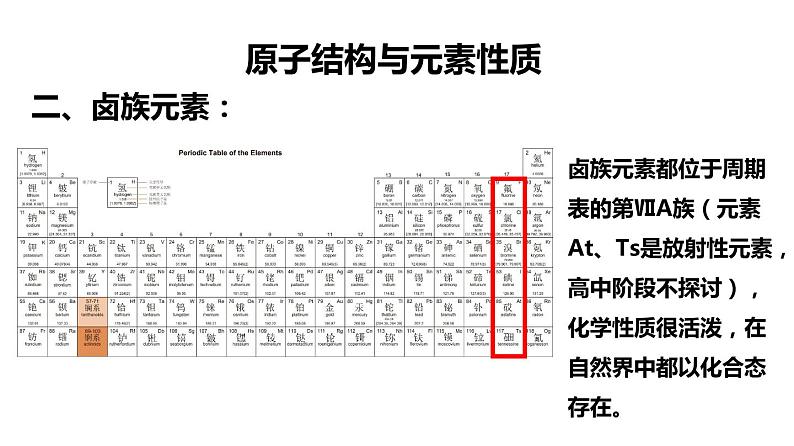
卤族元素都位于周期表的第ⅦA族(元素At、Ts是放射性元素,高中阶段不探讨),化学性质很活泼,在自然界中都以化合态存在。
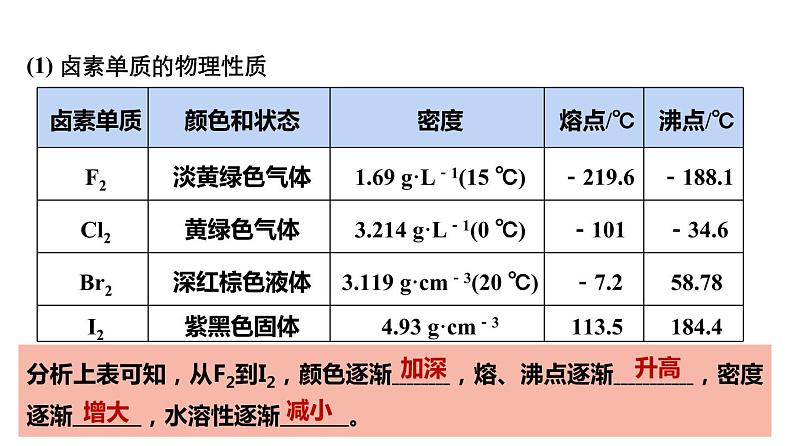
(1) 卤素单质的物理性质
分析上表可知,从F2到I2,颜色逐渐 ,熔、沸点逐渐 ,密度逐渐 ,水溶性逐渐 。
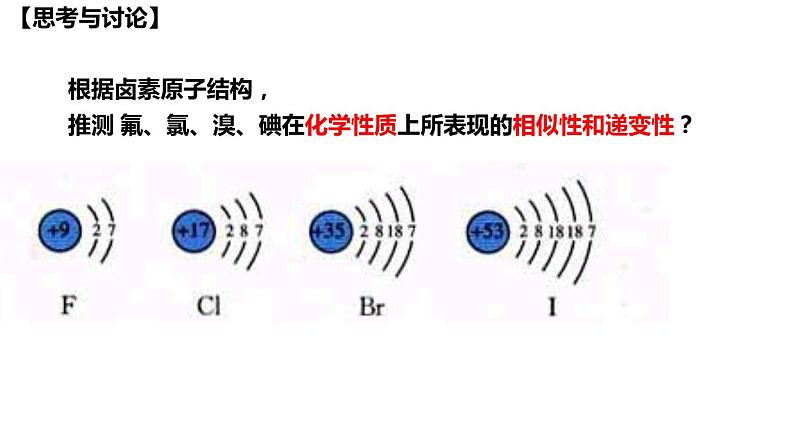
根据卤素原子结构,
推测 氟、氯、溴、碘在化学性质上所表现的相似性和递变性?
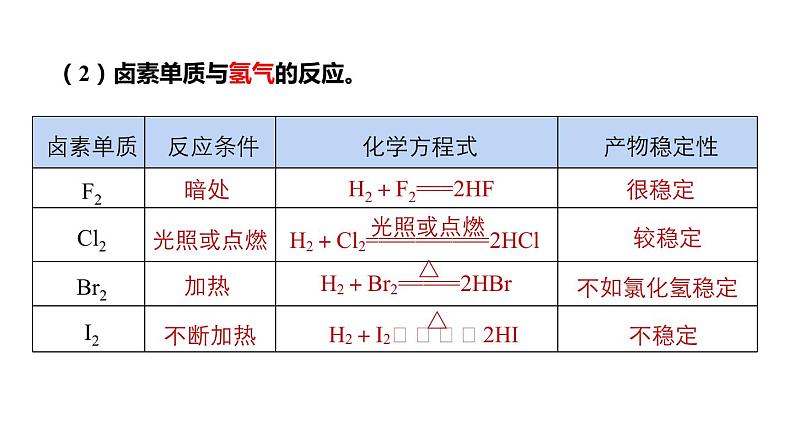
(2)卤素单质与氢气的反应。
H2+F2===2HF
(1)根据卤素的原子结构,请你试着推测氟、氯、溴、碘在化学性质上表现出的相似性和递变性。(2)根据卤素单质与氢气的反应事实,讨论随着原子核电荷数的增多,卤素单质与氢气反应的规律性变化。
从F2到I2,与H2反应所需要的条件逐渐 ,反应剧烈程度依次 ,生成气态氢化物的稳定性依次 。
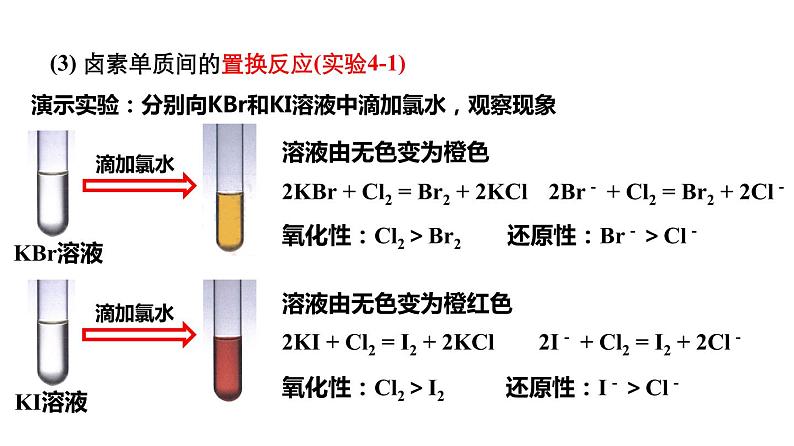
演示实验:分别向KBr和KI溶液中滴加氯水,观察现象
2KBr + Cl2 = Br2 + 2KCl
2KI + Cl2 = I2 + 2KCl
2Br- + Cl2 = Br2 + 2Cl-
氧化性:Cl2>Br2 还原性:Br->Cl-
2I- + Cl2 = I2 + 2Cl-
氧化性:Cl2>I2 还原性:I->Cl-
(3) 卤素单质间的置换反应(实验4-1)
2KI + Br2 = I2 + 2KBr
2I- + Br2 = I2 + 2Br-
氧化性:Br2>I2 还原性:I->Br-
演示实验:向KI溶液中滴加溴水,观察现象
由上得到氧化性:Cl2>Br2>I2;还原性:I->Br->Cl-
随着核电荷数的增加,卤族元素单质的氧化性,按照F2、Cl2、Br2、I2的顺序依次减弱
同主族元素由上到下原子核外电子层数依次增加,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,所以金属性逐渐增强,非金属性逐渐减弱。
(1)卤素单质都是双原子分子( )(2)单质At2是白色固体( )(3)同主族元素的单质熔、沸点一定是随核电荷数增加而升高( )(4)同主族元素从上至下非金属性逐渐增强( )(5)第ⅡA族的锶的硫酸盐(SrSO4)是易溶于水的白色固体( )
(1)F2通入水中会剧烈反应,且有另一种单质气体生成,请根据氧化还原反应理论书写化学方程式:_______________________。(2)氧化性F2>Cl2,那么能否用F2与NaCl溶液反应置换Cl2?
2F2+2H2O===4HF+O2
1.卤素的特殊性(1)在常温下Br2是唯一的液态非金属单质,易挥发。(2)碘为紫黑色固体,易升华,淀粉遇I2变蓝。(3)氟是最活泼的非金属,没有正化合价,氟单质与盐溶液反应时,先与水反应产生HF和O2。
1.卤素单质性质的相似性 (1) 与H2反应:X2+H2 。 (2) 与活泼金属(如Na)反应:2Na+X2 。 (3) 与H2O反应 ① X2+H2O (X=Cl、Br、I); ② 2F2+2H2O===4HF+O2。
2.卤素单质性质的递变性 (1) 氧化性与还原性 随着原子序数的递增:卤素单质的氧化性逐渐 ,卤素阴离子的还原性逐渐。 (2) 与H2反应的难易及氢化物稳定性 随着原子序数的递增: ① 与H2反应越来越 ,生成的氢化物的稳定性逐渐 ,还原性逐渐 ; ② 氢化物都易溶于水,其水溶液酸性依次增强,氢化物中HCl、HBr、HI的熔、沸点依次升高。
3.同主族元素的递变规律
1.下列有关碱金属元素和卤素的说法错误的是A.溴单质与H2的反应比碘单质与H2的反应更剧烈B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原 子得电子的能力最强C.钾与水的反应比钠与水的反应更剧烈D.随核电荷数的增加,碱金属元素单质和卤素单质的熔、沸点都逐渐 降低
2.含有元素硒(Se)的保健品已开始进入市场。已知它是第四周期第ⅥA族元素。则下列关于硒的叙述正确的是A.非金属性比硫强B.气态氢化物的化学式为H2SeC.稳定性:H2Se>H2OD.最高价氧化物的化学式是SeO2
3.(2020·河北行唐三中高一月考)下列事实不能说明非金属性Cl>I的是A.Cl2+2I-===2Cl-+I2B.稳定性:HCl>HIC.酸性:HClO4>HIO4D.酸性:HClO3>HIO3
4.据报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下列内容:(1)铯的原子核外共有___个电子层,最外层电子数为___,铯的原子序数为_____。
6 1
(2)铯单质与水剧烈反应,放出____色气体,同时使紫色石蕊溶液显____色,原因是__________________________(写出化学方程式)。(3)预测铯单质的还原性比钠单质的还原性_____(填“弱”或“强”)。
2Cs+2H2O===2CsOH+H2↑
题组二 卤族元素6.卤族元素的下列性质与它们原子的最外层电子数无关的是A.都能与钠反应 B.都可以形成无氧酸C.氟没有正价 D.均可形成氢化物
7.甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-或I-),向甲中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙中,颜色无明显变化。则甲、乙、丙依次含有A.Br-、Cl-、I- B.Br-、I-、Cl-C.I-、Br-、Cl- D.Cl-、I-、Br-
11.下列有关碱金属、卤素原子结构和性质的描述正确的是A.随着核电荷数的增加,卤素单质的熔、沸点依次升高,密度依次减小B.F、Cl、Br、I的最外层电子数都是7,Li、Na、K、Rb的最外层电子 数都是1C.碱金属单质的金属性很强,均易与氧气发生反应,加热时生成氧化物 R2OD.根据F、Cl、Br、I的非金属性依次减弱,可推出HF、HCl、HBr、HI 的还原性及热稳定性依次减弱
15.为证明卤族元素的非金属性强弱,某小组用如图所示装置进行实验(夹持仪器已略去,装置气密性已检查)。提示:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为橙红色时,关闭活塞a。Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是_______________________。
湿润的淀粉-KI试纸变蓝
(2)B中溶液发生反应的离子方程式是______________________
Cl2+2Br-===Br2+2Cl-
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________________________________________________________________________________。
量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后四氯化碳层变为紫红色
相关课件
这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教学演示课件ppt,共28页。PPT课件主要包含了最外层电子数1→2,最外层电子数1→8,原子半径逐渐减小,元素周期律等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料复习课件ppt,共36页。PPT课件主要包含了原子结构核素,随堂演练知识落实等内容,欢迎下载使用。
这是一份高中人教版 (2019)第一节 原子结构与元素周期表多媒体教学ppt课件,共31页。PPT课件主要包含了原子结构与元素周期表,核素同位素等内容,欢迎下载使用。










