





- 第四章第1节原子结构与元素周期表第1课时 课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 3 次下载
- 第四章第1节原子结构与元素周期表第2课时 课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 3 次下载
- 第四章第1节原子结构与元素周期表第3课时碱金属课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 3 次下载
- 第四章第1节原子结构与元素周期表第4课时卤素课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 2 次下载
- 第四章第2节元素周期律第3课时课件—2021-2022学年人教版(2019版)高一化学必修(第一册) 课件 4 次下载
高中化学人教版 (2019)必修 第一册第二节 金属材料复习课件ppt
展开原子结构与元素周期表复习
核外电子(Z个)——最外层电子数决定元素的______ 性质
1.构成原子的微粒及作用
质子(Z个)——决定 的种类
在质子数确定后决定 种类同位素
2.原子、离子中三种基本微粒的数量关系(1)原子中:质子数(Z)=核电荷数= ;(2)质量数(A)= (Z)+ (N);(3)阳离子的核外电子数=质子数- ;(4)阴离子的核外电子数=质子数+ 。
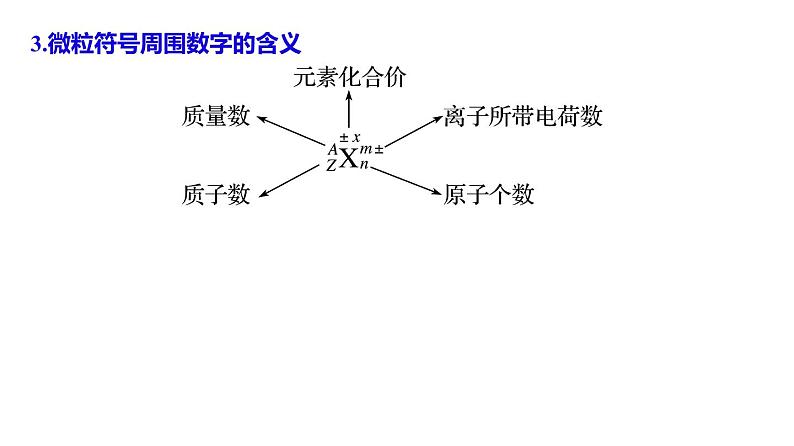
3.微粒符号周围数字的含义
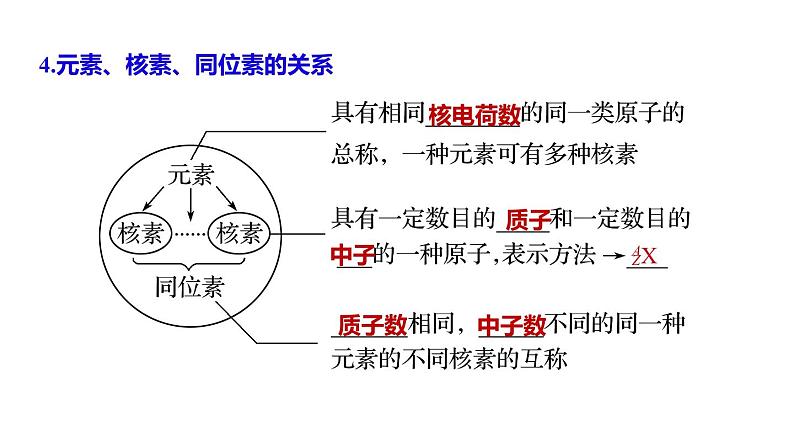
4.元素、核素、同位素的关系
(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子( )(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同( )(3)中子数不同而质子数相同的微粒一定互为同位素( )(4) 得电子能力几乎相同( )
1.已知:A.质子数,B.中子数,C.核外电子数,D.最外层电子数,用字母回答下列问题。(1)原子种类由______决定;(2)元素种类由______决定;(3)元素的化合价由_____决定。
NA(或6.02×1023)
(2)核内中子数为N的R2+,质量数为A,则该离子的核外电子数为__________。
二、元素周期表的结构以及元素在周期表中位置 的确定方法
2.确定主族元素在周期表中位置的方法(1)根据原子结构示意图来确定利用以下两个等量关系:①核外电子层数=周期数 ②主族序数=最外层电子数如某原子结构示意图为 ,其在周期表中的位置是____________ 。
(2)根据稀有气体元素的原子序数确定①记住稀有气体元素的原子序数(2He、10Ne、18Ar、36Kr、54Xe、86Rn、118Og),便可确定主族元素的位置。②原子序数-最邻近的稀有气体元素的原子序数=ΔZ若ΔZ>0,则位于稀有气体元素下一周期,族序数为ΔZ;若ΔZ<0,则与稀有气体元素同周期,族序数为8-|ΔZ|。如115号元素在元素周期表中的位置是 。
(1)第ⅠA族全部是金属元素( )(2)元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素( )(3)两短周期元素原子序数相差8,则周期数一定相差1( )(4)0族元素原子的最外层均有8个电子( )
请在下表中画出元素周期表的轮廓,并在表中按要求完成下列问题:(1)标出周期序数和族序数。(2)用阴影表示出碱金属元素的位置。(3)将前四周期卤族元素的元素符号填入表中适当的位置。(4)写出各周期元素的种类。(5)写出稀有气体元素的原子序数。(6)写出金属与非金属元素分界线处的金属元素符号。
下列说法正确的是A.同一周期中的第ⅡA族和第ⅢA族元素的原子序数差一定为1B.L层上的电子数为奇数的元素一定是主族元素C.同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种数D.族序数等于周期序数的元素一定是金属元素
三、同主族元素性质的相似性和递变性
1.同主族元素的性质具有相似性与递变性,下列关于碱金属元素与卤素的说法正确的是A.碱金属单质的密度随着原子序数增大而增大B.碱金属单质与氧气反应都能生成两种含氧化合物C.卤素单质的熔点随着原子序数增大而增大D.I2可以与Fe反应生成FeI3
2.元素周期表中卤族元素(F→I)的单质和化合物的性质,从上到下呈现一定的递变性。下列叙述正确的是①氢卤酸(HX)的酸性依次减弱 ②单质的颜色加深 ③气态氢化物的沸点依次增高④单质的沸点升高 ⑤阴离子的还原性增强A.①②④ B.②③④⑤ C.②④⑤ D.①③⑤
2.下列各图若为元素周期表的一部分(表中数字代表原子序数),其中合理的是
3.下列叙述正确的是A.元素周期表是按元素的相对原子质量排列而成的B.元素周期表中的副族和第Ⅷ族元素统称为过渡元素C.元素周期表共有7个横行(周期)和16个纵列(族)D.元素周期表中,短周期包括9种非金属元素
4.下列各项表述正确的一组是
5.短周期元素X、Y、Z在周期表中的位置关系如图所示,回答下列问题:(1)X元素形成单质的分子式是______。(2)写出Y元素形成的单质跟水反应的化学方程式:______________________。(3)写出Z元素的原子结构示意图:_________。
2F2+2H2O===4HF+O2
四、元素金属性、非金属性强弱的比较
1.金属性强弱的判断方法金属性:指金属元素原子在化学反应中失电子的能力通常用如下三种方法判断其强弱:(1)根据金属单质与水或非氧化性酸反应置换出氢气的难易程度判断,置换出氢气越容易,则金属性越强。(2)根据金属元素最高价氧化物对应的水化物的碱性强弱判断,碱性越强,则金属元素的金属性越强。(3)周期表中,金属性:同周期从左到右递减,同主族从上到下递增
2.非金属性强弱的判断方法非金属性:指非金属元素原子在化学反应中得电子的能力通常用如下三种方法判断其强弱:(1)根据非金属单质与H2化合的难易程度、生成气态氢化物的稳定性判断,越易化合,生成的气态氢化物越稳定,则非金属性越强。(2)根据非金属元素最高价氧化物对应的水化物的酸性强弱判断,酸性越强,则元素的非金属性越强。(3)周期表中,非金属性:同周期从左到右递增,同主族从上到下递减
1.已知铍(Be)的原子序数为4,下列关于铍及其化合物的叙述正确的是A.铍的金属性比镁强B.氯化镁的氧化性比氯化铍强C.氢氧化铍的碱性比氢氧化钙的弱D.单质铍易和冷水反应产生氢气
2.下列叙述中,能肯定A金属比B金属活动性强的是A.A原子的最外层电子数比B原子的最外层电子数少B.A原子的电子层数比B原子的电子层数多C.1 ml A从酸中置换出的氢气比1 ml B从酸中置换出的氢气多D.常温时,A能从水中置换出氢气而B不能
3.下列事实不能说明X元素比Y元素的非金属性强的是①与H2化合时,X单质比Y单质容易②X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强③X原子的最外层电子数比Y原子的最外层电子数多④X单质可以把Y从其氢化物中置换出来⑤X元素的最高正价比Y的高⑥气态氢化物溶于水后的酸性:X强于YA.②⑤⑥ B.③④⑥C.①④⑥ D.③⑤⑥
4.不能说明氧的非金属性比硫强的事实是A.H2O的热稳定性强于H2SB.H2S水溶液暴露于空气中变浑浊C.常温下H2O是液体,H2S是气体D.O2和H2化合比S和H2化合容易
人教版 (2019)必修 第一册第二节 元素周期律复习ppt课件: 这是一份人教版 (2019)必修 第一册第二节 元素周期律复习ppt课件,共60页。PPT课件主要包含了考点二元素的性质,考点四化学键,知识复习,题点呈现等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表课堂教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表课堂教学课件ppt,共42页。PPT课件主要包含了活动1分类,分类一,思考分类的依据,分类二,分类三,现有元素,元素组A,元素组B,元素组C,分类依据等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教学演示课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教学演示课件ppt,共28页。PPT课件主要包含了最外层电子数1→2,最外层电子数1→8,原子半径逐渐减小,元素周期律等内容,欢迎下载使用。













